Взгляд через влажную пленку — Центр глазной хирургии
Среди различных глазных заболеваний все более заметное место в последнее время занимает так называемый синдром сухого глаза. Врачи называют его еще роговично-конъюнктивальный ксероз. По данным Всемирной организации здравоохранения, им страдает около 30% взрослого населения Земли. Причем, если лет 15 назад этот недуг встречался преимущественно у пожилых людей, то сегодня он нередко поражает молодых, особенно занимающихся интеллектуальным трудом и долгие часы проводящих за компьютером.
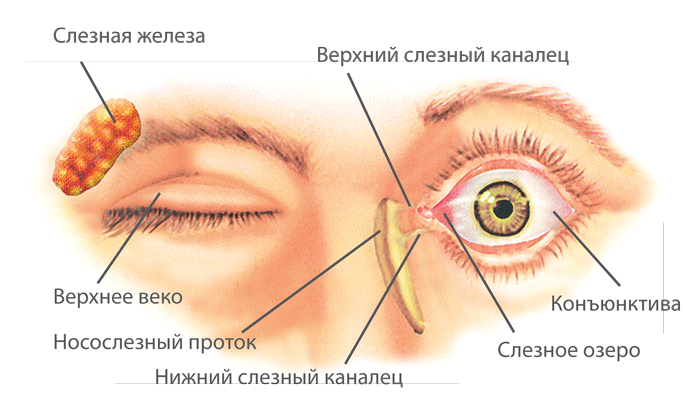
Суть заболевания – в недостаточном смачивании таких важных оболочек глаза, как роговица и конъюнктива, слезной жидкостью. Она выделяется слезными железами, расположенными под внешними углами верхних век, и формирует тончайшую слезную пленку. О последней следует сказать особо.
Слезная пленка состоит из трех слоев: наружного (липидного), среднего (водянистого) и внутреннего (муцинового). Первый образован липидами, то есть жирами, предохраняющими слезную пленку от испарения влаги. Средний слой состоит из слезной жидкости, постоянно смачивающей роговицу и конъюнктиву и доставляющей к ним питательные вещества и кислород. И наконец, плотно прилегающий к роговице и обеспечивающий ее защиту муциновый слой.
Средний слой состоит из слезной жидкости, постоянно смачивающей роговицу и конъюнктиву и доставляющей к ним питательные вещества и кислород. И наконец, плотно прилегающий к роговице и обеспечивающий ее защиту муциновый слой.
В норме слезная пленка, покрывающая переднюю поверхность глазного яблока, примерно каждые 10 секунд разрывается, вызывая мигание век и обновление слезной жидкости. Однако под влиянием негативных факторов, например длительной работы за компьютером или ношения контактных линз, частота разрывов может увеличиваться, и тогда слезная пленка не успевает восстанавливаться. В результате пересыхает роговица, что и приводит к недугу.
Среди факторов, способствующих появлению недуга, следует в первую очередь отметить возрастные изменения. Установлено, что уже после 40 лет выработка слезной жидкости начинает уменьшаться, а после шестидесяти ее «производство» заметно снижается. К тому же пожилые люди зачастую имеют те или иные заболевания внутренних органов, которые отрицательно сказываются на составе слезной жидкости.
Помимо возрастного фактора возникновению синдрома способствуют генетическая предрасположенность, перенесенные офтальмологические операции, инфекции, заболевания эндокринной системы (например сахарный диабет), гормональная недостаточность в период климакса, прием оральных контрацептивов, выраженный дефицит витамина А.
«К основным признакам этого патологического состояния относятся слезотечение, ощущение инородного тела, песка, быстрая утомляемость, расплывчатое зрение, покраснение глаз, – рассказывает кандидат медицинских наук Дмитрий Покровский, заместитель руководителя кафедры офтальмологии Российского национального исследовательского медицинского университета имени Н.И. Пирогова. – Порой, если эти симптомы выражены слабо, их принимают за обычную усталость органа зрения. Однако после обращения к специалисту и проведения необходимых исследований выясняется, что на самом деле у пациента развивается именно синдром сухого глаза. В связи с этим следует отметить, что в зависимости от выраженности симптомов в клинической практике различают легкую, среднюю и тяжелую формы синдрома».
Так, если пациента периодически беспокоит слезотечение, появляющееся при ветре или на холоде, то речь идет о легкой форме. Средняя степень синдрома сухого глаза характеризуется тем, что эти неприятные симптомы возникают чаще и выраженность их усиливается. Кроме того, к ним добавляются еще ощущение инородного тела, песка, покраснение глаз. Что касается тяжелой степени, то при этом возникают патологические изменения в роговице и конъюнктиве, вызванные воспалительными явлениями, в частности, могут образовываться микроэрозии и даже язва роговицы, которые приводят к ухудшению зрения.
«Если вы работаете за компьютером, то через каждые 10 минут посмотрите в окно и несколько секунд поморгайте, – советует Дмитрий Покровский. – Это заставляет слезные железы интенсивнее выделять жидкость. Помните, в минуту надо совершать не менее 20 моргательных движений. Кроме того, не подставляйте глаза под воздушные потоки, исходящие от вентилятора или кондиционера. Важно также, чтобы уровень влажности в помещении составлял примерно 50%. Необходимо чаще проветривать комнату и избегать прокуренных и пыльных помещений. А выходя на улицу в яркие солнечные дни, надевайте защитные очки».
Необходимо чаще проветривать комнату и избегать прокуренных и пыльных помещений. А выходя на улицу в яркие солнечные дни, надевайте защитные очки».
Но главный совет – в случае, если у вас разыгрался синдром сухого глаза, не занимайтесь самолечением, а обращайтесь к офтальмологу. Он назначит необходимые капли, содержащие вещества, которые входят в состав естественной слезной пленки. В тяжелых случаях удержать слезу помогают также миниатюрные тампоны, которые помещают в слезные протоки. Они состоят из специальных биополимеров и могут быть как временными, так и постоянными. Благодаря тампонам слезная жидкость не стекает по системе оттока в полость носа, а удерживается на поверхности глаза и, следовательно, предотвращает прогрессирование синдрома.
Необходимо подчеркнуть, что многие заболевания глаз поначалу протекают скрытно и лучше всего поддаются лечению именно на ранних стадиях. Поэтому надо хотя бы раз в год наведываться к офтальмологу.
Независимая газета
Слезная пленка: функция | Дельфанто
На поверхности глаза постоянно присутствует пленка из слез.
Строение слезной пленки
98% слезной жидкости составляет вода, а 2% приходится на неорганические соли и электролиты, также компонентами слезной пленки являются липиды, белки, мукополисахариды, прочие органические соединения.
Если человек здоров, слеза представляет собой «пирог». Строение слезной пленки, следующее:
- сверху слой липидов, он контактирует с воздухом;
- затем следует водный слой;
- самый последний –муциновый слой, контактирующий с роговицей.
Пленкой покрыта передняя часть роговой оболочки, потому в нормальном состоянии она обладает идеальной гладкостью и прозрачностью.
Слезная пленка: функции
Липидный слой, содержащий секрет мейбомиевых желез, служит для защиты водного слоя, не давая ему испаряться, кроме того, он способствует образованию на поверхности глаза слезной пленки. Муциновый слой служит для связки водного слоя с роговицей.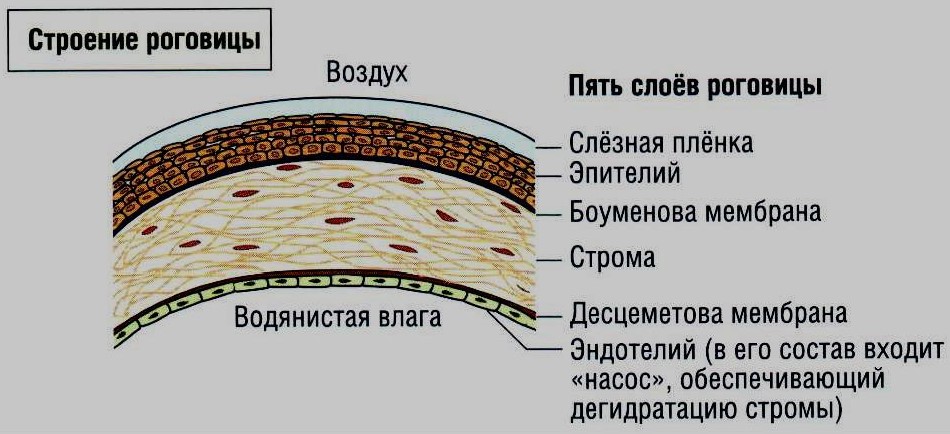
Благодаря слезной пленке глаз защищен. Слезы удаляют с поверхности органа зрения инородные тела, например, соринку или ресничку, а также патогенных микроорганизмов. Они увлажняют роговицу и конъюнктиву, улучшают оптические характеристики глаза. За счет нее происходит питание роговицы, ведь в составе слезной жидкости присутствуют белки, соли и липиды.
Причины и симптомы синдрома «сухого глаза»
Толщина слезной пленки глаза составляет 6-12 мкм. Каждые 10 секунд она разрывается, запускается процесс мигания и ее обновления, восстановления. Но иногда происходит сбой, в результате которого пленка разрывается гораздо быстрее, что приводит к тому, что глаза пересыхают.
Около 15-17% взрослых людей сталкиваются с синдромом «сухого глаза». Чаще всего он развивается у людей, которые на протяжении длительного времени пользуются смартфоном, планшетом или компьютером, находятся в кондиционируемых помещениях.
ССГ развивается из-за того, что слезы становится недостаточно и ее качество ухудшается.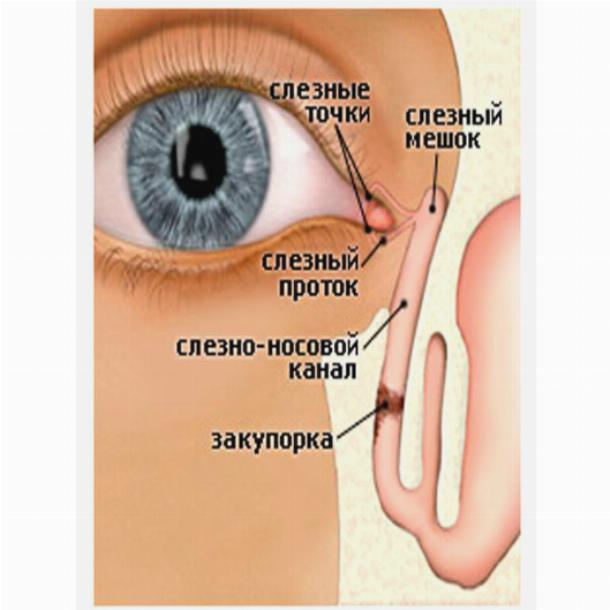 Она не может удерживаться в роговице, быстро испаряется. К этому состоянию могут приводить аутоиммунные, эндокринные заболевания, болезни крови, почек, инфекции, беременность, пр. Также причиной сухого кератоконъюнктивита может стать проведение коррекции зрения и прочие операции на глазах.
Она не может удерживаться в роговице, быстро испаряется. К этому состоянию могут приводить аутоиммунные, эндокринные заболевания, болезни крови, почек, инфекции, беременность, пр. Также причиной сухого кератоконъюнктивита может стать проведение коррекции зрения и прочие операции на глазах.
В зоне риска люди, которые носят линзы, принимают гормональные препараты, используют глазные лекарства.
При синдроме сухого глаза могут назначаться специальные капли. Их нужно использовать несколько раз в день. Но длительное их применение может привести к вымыванию из глаз важных компонентов слезы, что меняет ее состав. В отличие от глазных капель капсулы Дельфанто нужно принимать всего раз в день. Они содержат экстракт Аристотелии чилийской, способствуют нормализации выработки собственной слезы.
Сложность слезной пленки: значение для гомеостаза и дисфункции во время болезни
Слезная пленка представляет собой уникальный тонкий слой жидкости толщиной примерно 3 мкм и объемом 3 мкл, покрывающий внешние поверхности слизистой оболочки глаза.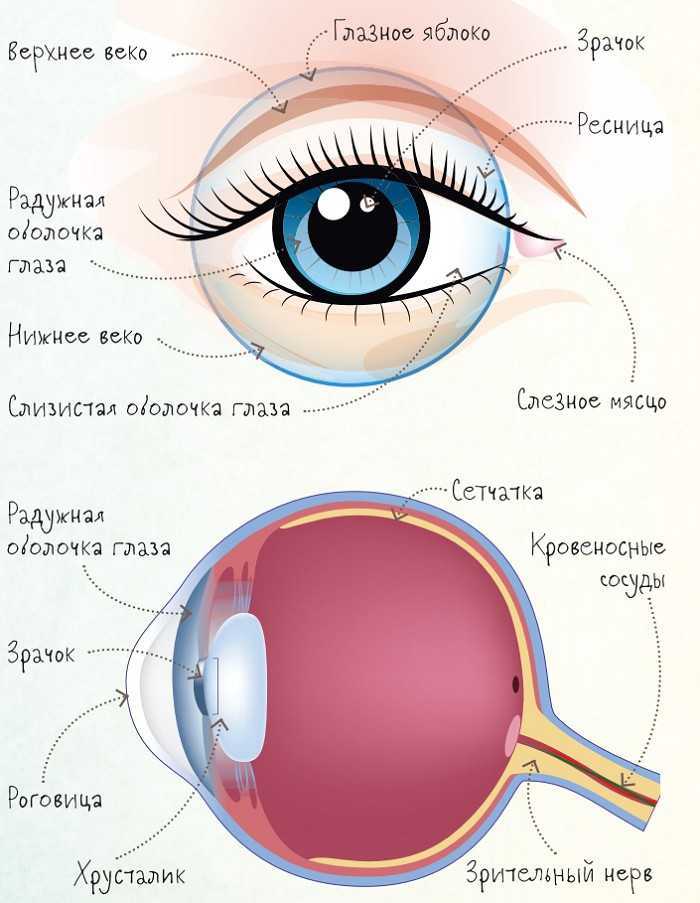 Таким образом, это интерфейс поверхности глаза с окружающей средой. Эта пленка прозрачна и имеет водную/муциновую фазу, концентрация муцина уменьшается по направлению к отчетливому поверхностному липидному слою. Эти слои или регионы содержат различные биохимические процессы, лежащие в основе различных функций. Липидный слой слезной пленки тонкий, порядка 50–100 нм, но содержит множество различных видов липидов, включая неполярные липиды, такие как сложные эфиры холестерина и воска, которые составляют его объем, и полярные липиды, такие как (O-ацил )-ω-оксижирные кислоты и фосфолипиды, взаимодействующие с водным слоем. Большинство этих липидов, за возможным исключением фосфолипидов, секретируются мейбомиевыми железами, расположенными на краю века. Наиболее существенная роль липидного слоя заключается в замедлении испарения слез с поверхности глаза. Водно-муциновый слой образует основную часть слез. Большая часть водной жидкости секретируется слезными железами, которые также выделяют определенный набор белков, электролитов и воды.
Таким образом, это интерфейс поверхности глаза с окружающей средой. Эта пленка прозрачна и имеет водную/муциновую фазу, концентрация муцина уменьшается по направлению к отчетливому поверхностному липидному слою. Эти слои или регионы содержат различные биохимические процессы, лежащие в основе различных функций. Липидный слой слезной пленки тонкий, порядка 50–100 нм, но содержит множество различных видов липидов, включая неполярные липиды, такие как сложные эфиры холестерина и воска, которые составляют его объем, и полярные липиды, такие как (O-ацил )-ω-оксижирные кислоты и фосфолипиды, взаимодействующие с водным слоем. Большинство этих липидов, за возможным исключением фосфолипидов, секретируются мейбомиевыми железами, расположенными на краю века. Наиболее существенная роль липидного слоя заключается в замедлении испарения слез с поверхности глаза. Водно-муциновый слой образует основную часть слез. Большая часть водной жидкости секретируется слезными железами, которые также выделяют определенный набор белков, электролитов и воды. Эпителий конъюнктивы является вторым источником электролитов и воды в слезах. Водная фаза снабжает кислородом и питательными веществами бессосудистую ткань роговицы и вымывает эпителиальные остатки, токсины и инородные тела. Многие из муцинов секретируются специализированными бокаловидными клетками эпителия конъюнктивы, а некоторые трансмембранные муцины выделяются в слезную пленку эпителиальными клетками роговицы и конъюнктивы. При закреплении в эпителиальных клетках эти трансмембранные муцины проникают в водную фазу и помогают стабилизировать слезную пленку.
Эпителий конъюнктивы является вторым источником электролитов и воды в слезах. Водная фаза снабжает кислородом и питательными веществами бессосудистую ткань роговицы и вымывает эпителиальные остатки, токсины и инородные тела. Многие из муцинов секретируются специализированными бокаловидными клетками эпителия конъюнктивы, а некоторые трансмембранные муцины выделяются в слезную пленку эпителиальными клетками роговицы и конъюнктивы. При закреплении в эпителиальных клетках эти трансмембранные муцины проникают в водную фазу и помогают стабилизировать слезную пленку.
Производство слез регулируется. Слезные и мейбомиевы железы получают как парасимпатическую, так и симпатическую иннервацию, и считается, что бокаловидные клетки также находятся под нейрогенным контролем через парасимпатическую иннервацию. Глазная поверхность богато иннервирована тройничными афферентными нервами. Роговица и края век особенно плотно иннервированы. Входы и выходы этих нервов образуют основу рефлекторной дуги, которая регулирует секрецию слезы в соответствии с повседневными потребностями.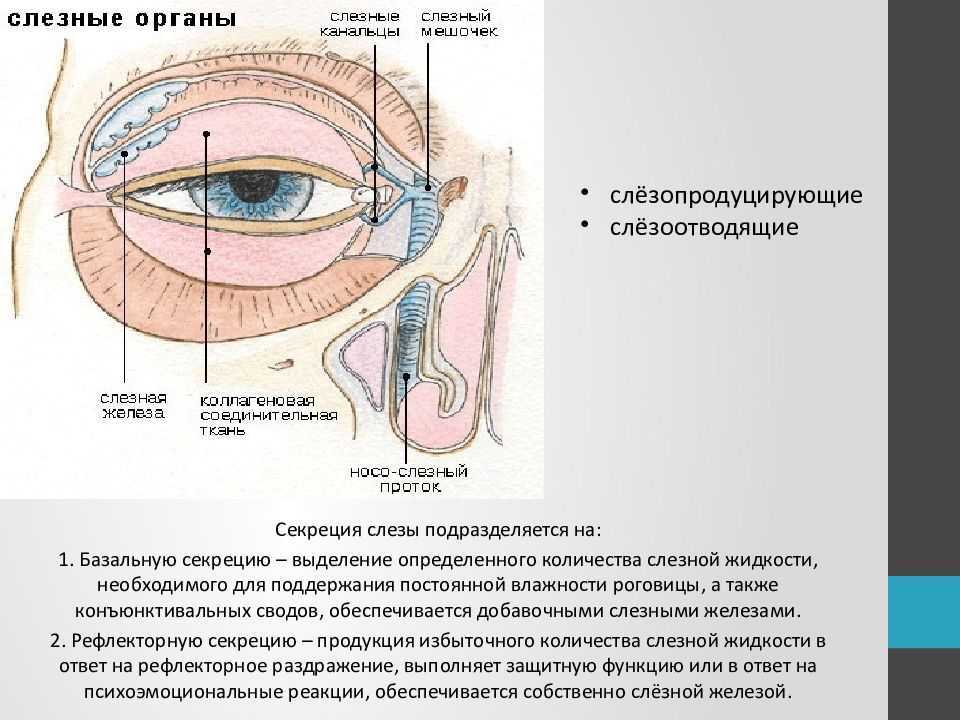 Мениски, лежащие на стыке краев век и поверхности глазного яблока, позволяют слезам двигаться к слезным точкам и канальцам, откуда они стекают в носослезную систему. Слезы, потерянные в результате испарения и дренажа, замещаются слезной секрецией. Скорость оборота слезы составляет 1–3 мкл/мин в нормальных условиях, но может значительно увеличиваться при стимуляции раздражителями или в ответ на эмоции. Действительно, были описаны три различных типа слез; базальные слезы, которые в норме присутствуют на поверхности глаза, рефлекторные слезы, возникающие при стимуляции, и слезы при закрытых глазах, которые омывают глаза во время сна. Каждый из этих типов слез содержит свою уникальную биохимию. Например, уровни секреторного иммуноглобулина-А (sIgA) снижаются в концентрации от закрытых глаз к базальным и рефлекторным слезам, тогда как другие белки слезы, такие как лактоферрин, липокалин-1 и лизоцим, не изменяют заметно своей концентрации в различных типах слезы. .
Мениски, лежащие на стыке краев век и поверхности глазного яблока, позволяют слезам двигаться к слезным точкам и канальцам, откуда они стекают в носослезную систему. Слезы, потерянные в результате испарения и дренажа, замещаются слезной секрецией. Скорость оборота слезы составляет 1–3 мкл/мин в нормальных условиях, но может значительно увеличиваться при стимуляции раздражителями или в ответ на эмоции. Действительно, были описаны три различных типа слез; базальные слезы, которые в норме присутствуют на поверхности глаза, рефлекторные слезы, возникающие при стимуляции, и слезы при закрытых глазах, которые омывают глаза во время сна. Каждый из этих типов слез содержит свою уникальную биохимию. Например, уровни секреторного иммуноглобулина-А (sIgA) снижаются в концентрации от закрытых глаз к базальным и рефлекторным слезам, тогда как другие белки слезы, такие как лактоферрин, липокалин-1 и лизоцим, не изменяют заметно своей концентрации в различных типах слезы. .
Одной из основных функций слезной пленки является защита поверхности глаза от потенциально патогенных микробов, и она чрезвычайно эффективна в этой функции. В здоровом глазу кажущаяся плотность микробиоты глазной поверхности очень низкая, а типы микробов очень ограничены. По сравнению с микробиомом другой поверхности слизистой оболочки, такой как ротовая полость или кишечный тракт, поверхность глаза практически не колонизируется микробами. Это происходит из-за нескольких факторов, включая вытирание век во время моргания (что также помогает восполнить слезы), отшелушивание эпителиальных клеток и множество разнообразных и избыточных противомикробных препаратов в слезах. Муцины могут выполнять антимикробную функцию, действуя как рецепторы-приманки для микробов, предотвращая их прилипание к подлежащим тканям. Многие из основных белков слезной пленки, такие как лизоцим, лактоферрин и sIgA, либо непосредственно токсичны для бактерий (лизоцим, представляющий собой фермент, гидролизующий пептидогликаны клеточных стенок бактерий), либо уменьшают количество питательных веществ, необходимых для микробного роста (лактоферрин хелатирует железо). Секреторный IgA предотвращает адгезию микробов к эпителию и усиливает фагоцитоз (sIgA) нейтрофилами, которые попадают в слезную пленку во время сна для патрулирования и защиты закрытого глазного яблока.
В здоровом глазу кажущаяся плотность микробиоты глазной поверхности очень низкая, а типы микробов очень ограничены. По сравнению с микробиомом другой поверхности слизистой оболочки, такой как ротовая полость или кишечный тракт, поверхность глаза практически не колонизируется микробами. Это происходит из-за нескольких факторов, включая вытирание век во время моргания (что также помогает восполнить слезы), отшелушивание эпителиальных клеток и множество разнообразных и избыточных противомикробных препаратов в слезах. Муцины могут выполнять антимикробную функцию, действуя как рецепторы-приманки для микробов, предотвращая их прилипание к подлежащим тканям. Многие из основных белков слезной пленки, такие как лизоцим, лактоферрин и sIgA, либо непосредственно токсичны для бактерий (лизоцим, представляющий собой фермент, гидролизующий пептидогликаны клеточных стенок бактерий), либо уменьшают количество питательных веществ, необходимых для микробного роста (лактоферрин хелатирует железо). Секреторный IgA предотвращает адгезию микробов к эпителию и усиливает фагоцитоз (sIgA) нейтрофилами, которые попадают в слезную пленку во время сна для патрулирования и защиты закрытого глазного яблока. Они могут действовать синергически, усиливая их противомикробное действие. Кроме того, слезы содержат богатый набор антимикробных пептидов. Эти пептиды, такие как дефенсины, дестабилизируют мембраны микробных клеток до такой степени, что нормальная мембранная функция теряется, и мембраны могут даже лопнуть.
Они могут действовать синергически, усиливая их противомикробное действие. Кроме того, слезы содержат богатый набор антимикробных пептидов. Эти пептиды, такие как дефенсины, дестабилизируют мембраны микробных клеток до такой степени, что нормальная мембранная функция теряется, и мембраны могут даже лопнуть.
Динамический характер слезной пленки, возможно, позволяет ей переносить введение контактных линз. Это относительно безопасная форма коррекции зрения, которую носят около 140 миллионов человек в мире. Однако введение контактных линз может нарушить стабильность слезной пленки, и нормальная слоистая слезная пленка, вероятно, никогда не образуется в течение длительного времени на поверхности контактных линз, как это происходит сегодня. Контактные линзы увеличивают испарение слезной пленки примерно в 2 раза, а слезная пленка распадается на контактной линзе примерно в два раза быстрее, чем на поверхности роговицы. Даже при этих нарушениях необходимы многочисленные проблемы или факторы, вызывающие заболевание поверхности глаза.
Если болезнь все же возникает, основными формами болезни являются либо сухость глаз, глазная аллергия, либо те, которые связаны с ношением контактных линз. Болезнью сухого глаза страдают ≥20% населения. Считается, что этиология этого заболевания связана с воспалением поверхности глаза и/или слезной железы и чрезмерным испарением слез. Испарение увеличивает осмолярность слезной пленки, что может привести к воспалению и порочному кругу, который может потребовать противовоспалительной терапии, чтобы разрушить его и облегчить симптомы. Глазная аллергия представляет собой спектр клинических состояний, начиная от обычных состояний сезонного аллергического конъюнктивита и заканчивая клинически более тяжелыми и хроническими заболеваниями весеннего или атопического кератоконъюнктивита. Каждая форма заболевания включает различные клеточные и молекулярные пути. Эпителиальные клетки конъюнктивы, вероятно, первыми сталкиваются с переносимыми по воздуху аллергенами и реагируют на них высвобождением цитокинов.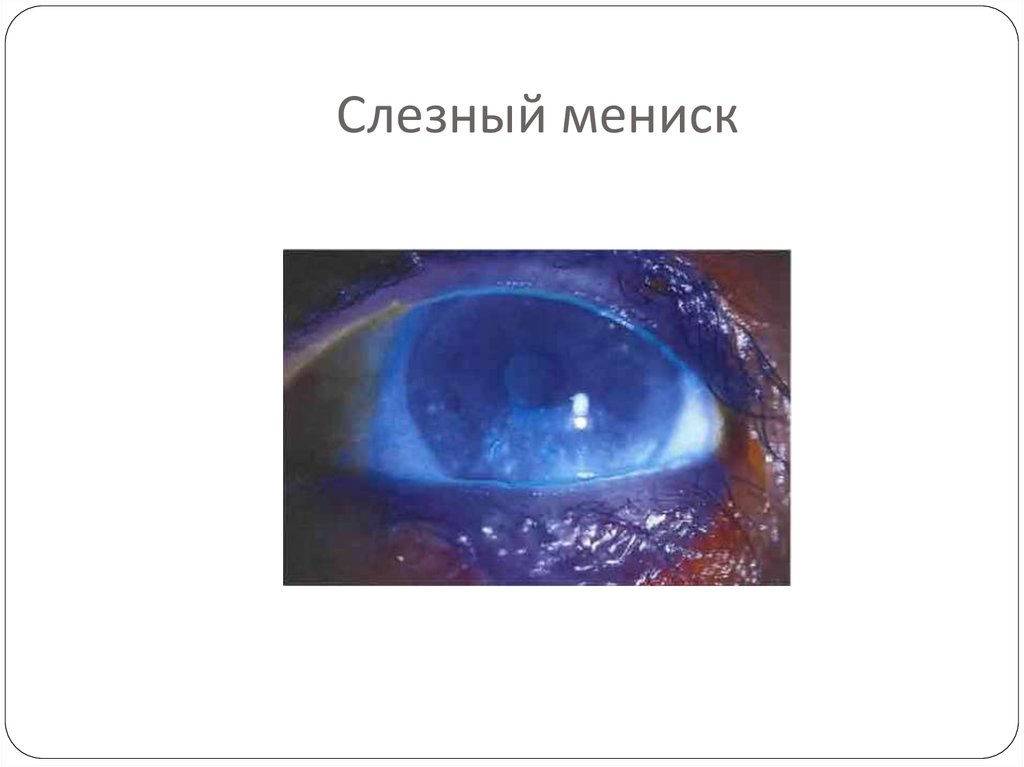 Недавние данные свидетельствуют о причастности бокаловидных клеток к патологии аллергического конъюнктивита через гистамин и лейкотриены. Тучные клетки конъюнктивы могут распознавать аллергены и высвобождать гистамин и множество других медиаторов воспаления.
Недавние данные свидетельствуют о причастности бокаловидных клеток к патологии аллергического конъюнктивита через гистамин и лейкотриены. Тучные клетки конъюнктивы могут распознавать аллергены и высвобождать гистамин и множество других медиаторов воспаления.
Способность поверхности глаза реагировать на заболевания и динамичный характер слезной пленки побудили людей искать в слезах биомаркеры различных заболеваний. Были показаны изменения протеома слезной пленки в ответ на местные заболевания, такие как сухость глаз. Но биохимия слез также меняется в ответ на заболевания глаз, такие как ретинопатия, связанная с диабетом. Возможно, более удивительно, что в слезах были обнаружены биомаркеры, которые, по-видимому, демонстрируют хорошую специфичность и чувствительность при диагностике отдаленных заболеваний, таких как рак молочной железы.
Слезная пленка еще не полностью охарактеризована с точки зрения состава, структуры и функции. Но недавние достижения во многих из этих областей освещаются в рукописях этого Специального выпуска «Экспериментальных исследований глаз».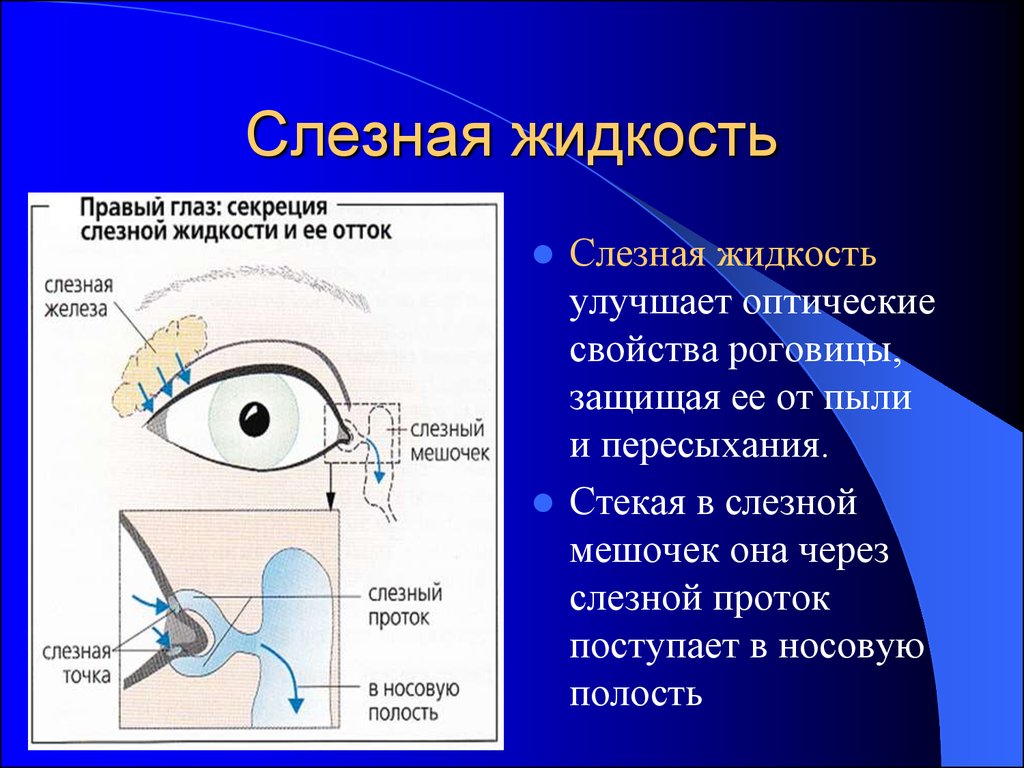
Бутович изучил опубликованные данные о липидоме слезы. Этот важный внешний слой слезы, скорее всего, участвует в предотвращении испарения слезной пленки и, возможно, в обеспечении стабильности всей слезной пленки. Новые аналитические методы и приборы (в первую очередь те, которые основаны на масс-спектрометрии) привели к высокой чувствительности и селективности, что привело к резкому расширению наших знаний о биохимии липидов мейбомиевых желез и слезной пленки. Мейбум состоит в основном из сложных эфиров воска и холестерина, что составляет до 70% от общего количества. Поскольку эти сложные эфиры воска и холестерина обладают высокой гидрофобностью, слезы содержат полярные липиды, включая (O-ацил)-ω-гидроксижирные кислоты и фосфолипиды. Хотя эти полярные липиды присутствуют в меньшем количестве (<5% от общего количества), они важны для распределения липидного слоя по водной слезной пленке.
Суини, Миллар и Раджу проанализировали современные знания о стабильности слезной пленки.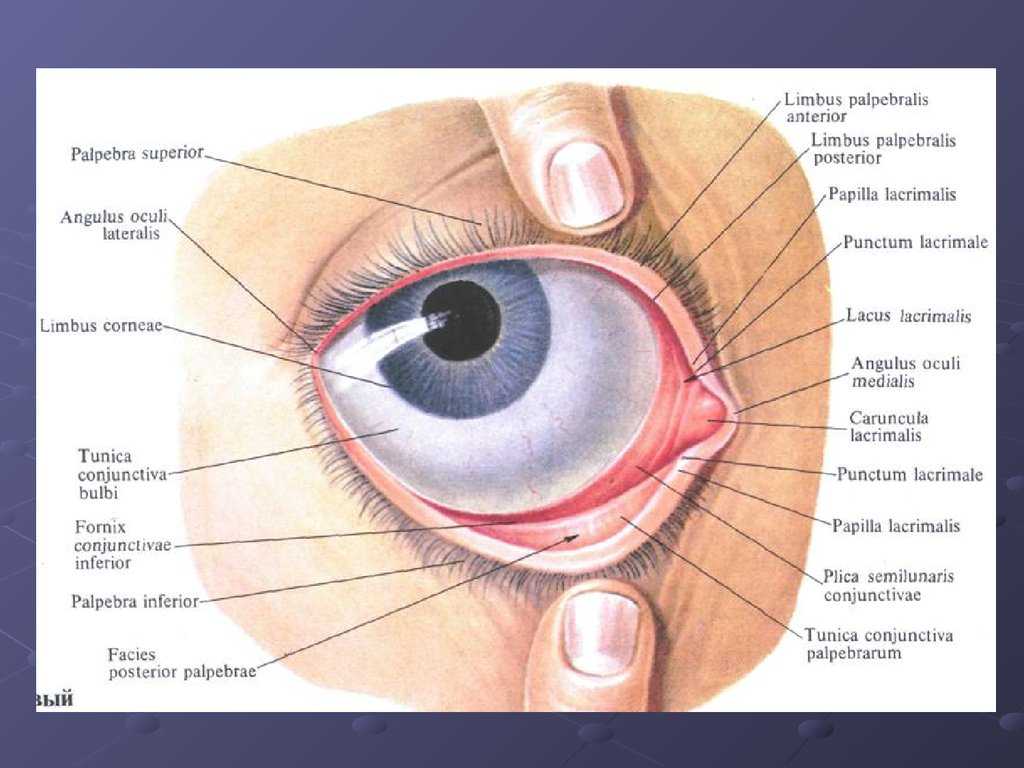 В их обзоре отмечен ряд как клинических, так и лабораторных методов, которые использовались для изучения стабильности слезной пленки. Стабильность слезной пленки, вероятно, важна при многих состояниях, в том числе при синдроме сухого глаза и при ношении контактных линз. Время разрыва слезной пленки после закапывания флуоресцеина можно измерить с помощью биомикроскопии с щелевой лампой, хотя воспроизводимость этого измерения плохая. Попытки повысить повторяемость включали использование неинвазивных методов, которые часто включали наблюдение освещенной сетки, отраженной от передней слезной поверхности, или систем топографии роговицы. Разрабатываются новые методы, которые позволяют одновременно исследовать разрыв слезной пленки и липидный слой и его детали во время истончения слезы. Скорость испарения слезной пленки часто была центральной точкой во многих исследованиях стабильности слезной пленки. Скорость испарения контролируется липидным слоем слезной пленки. Образование жидких кристаллов липидов слезной пленки, ориентированных под прямым углом к поверхности, может скреплять друг друга и препятствовать коллапсу липидного слоя и, следовательно, предотвращать испарение.
В их обзоре отмечен ряд как клинических, так и лабораторных методов, которые использовались для изучения стабильности слезной пленки. Стабильность слезной пленки, вероятно, важна при многих состояниях, в том числе при синдроме сухого глаза и при ношении контактных линз. Время разрыва слезной пленки после закапывания флуоресцеина можно измерить с помощью биомикроскопии с щелевой лампой, хотя воспроизводимость этого измерения плохая. Попытки повысить повторяемость включали использование неинвазивных методов, которые часто включали наблюдение освещенной сетки, отраженной от передней слезной поверхности, или систем топографии роговицы. Разрабатываются новые методы, которые позволяют одновременно исследовать разрыв слезной пленки и липидный слой и его детали во время истончения слезы. Скорость испарения слезной пленки часто была центральной точкой во многих исследованиях стабильности слезной пленки. Скорость испарения контролируется липидным слоем слезной пленки. Образование жидких кристаллов липидов слезной пленки, ориентированных под прямым углом к поверхности, может скреплять друг друга и препятствовать коллапсу липидного слоя и, следовательно, предотвращать испарение. Авторы также рассматривают такие факторы, как ношение контактных линз, окружающая среда и этническая принадлежность, которые могут повлиять на стабильность слезной пленки.
Авторы также рассматривают такие факторы, как ношение контактных линз, окружающая среда и этническая принадлежность, которые могут повлиять на стабильность слезной пленки.
Karnati, Laurie и Laurie сосредоточились на белках слезы, особенно на лакритине и липокалине-1, как на потенциальных биомаркерах, мишенях для лекарств и, возможно, биотерапевтических средствах при заболеваниях глазной поверхности. Эпителий глазной поверхности и глазные придатки, особенно слезная железа, секретируют большое количество белков в слезную пленку. Мало исследований было сосредоточено на идентификации множества белков слезы и определении их функции на поверхности глаза. Белки слезы как естественные биотерапевтические средства могут быть эффективны при лечении заболеваний глазной поверхности, особенно синдрома сухого глаза, поскольку они могут облегчать определенные симптомы, а не оказывать паллиативное действие. Выделены лакритин и липокалин-1, секретируемые слезной железой. Эти два белка многофункциональны, и описаны их различные роли в слезной пленке.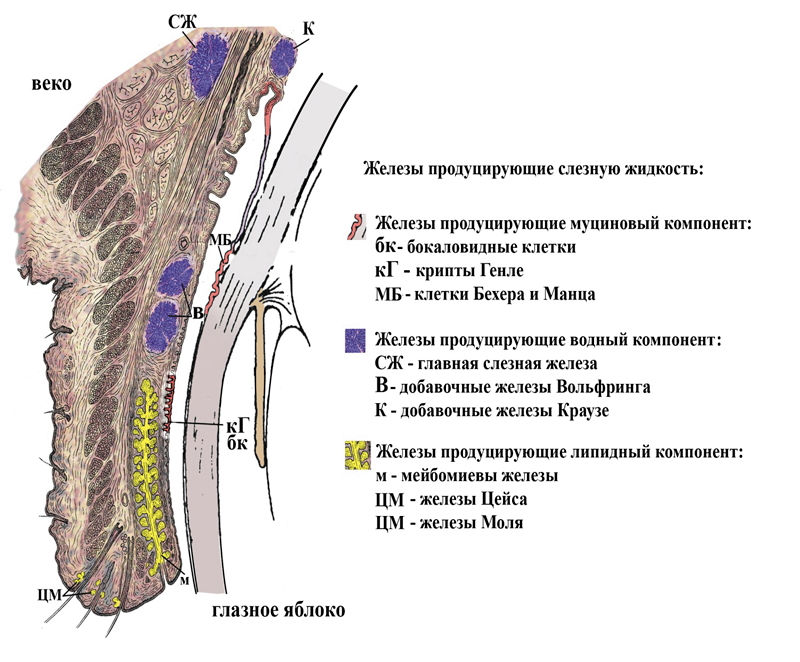
McDermott рассмотрел противомикробные соединения в слезах. В слезах содержится много белков с антимикробной активностью, таких как лизоцим, лактоферрин, секреторный иммуноглобулин А, а также другие менее известные соединения, такие как секреторная фосфолипаза А2 и малые катионные белки, такие как β-дефенсины. В настоящее время отсутствуют убедительные доказательства антимикробной активности всех этих белков в слезах, но есть примеры синергизма между антимикробными белками в слезах, которые могут способствовать действию многих из них, даже когда они находятся в низких концентрациях. Исследование влияния факторов, таких как ношение контактных линз, которые связаны с повышенной микробной инфекцией, на уровни антимикробных белков, является областью, определенной для дальнейших исследований. Высокая концентрация и типы противомикробных препаратов в слезах, возможно, помогают объяснить небольшое количество культивируемых микробов, которые можно выделить с поверхности глаза.
Hodges и Dartt исследовали муциновый слой слезной пленки. Более двадцати муцинов, идентифицированных на сегодняшний день, делятся на мелкие секреторные, крупные гелеобразующие и трансмембранные. Хотя большинство тканей, вырабатывающих слезы, также секретируют муцины, наиболее важными муцинами для защиты глазной поверхности являются большой гелеобразующий муцин MUC5AC, секретируемый бокаловидными клетками конъюнктивы, и трансмембранные муцины MUC1, MUC4 и MUC16, продуцируемые конъюнктивальными бокаловидными клетками. многослойные чешуйчатые клетки роговицы и конъюнктивы. Эти муцины образуют слой слезной пленки, наиболее близкий к поверхности эпителия роговицы и конъюнктивы, и, таким образом, играют важную защитную и гомеостатическую роль. Образование муцина слезной пленки может быть нарушено заболеванием поверхности глаза и, таким образом, может способствовать прогрессированию заболевания. Муцины продуцируются всеми влажными слизистыми оболочками тела, но лучше всего изучены муцины, продуцируемые дыхательными путями и желудочно-кишечным трактом.
Более двадцати муцинов, идентифицированных на сегодняшний день, делятся на мелкие секреторные, крупные гелеобразующие и трансмембранные. Хотя большинство тканей, вырабатывающих слезы, также секретируют муцины, наиболее важными муцинами для защиты глазной поверхности являются большой гелеобразующий муцин MUC5AC, секретируемый бокаловидными клетками конъюнктивы, и трансмембранные муцины MUC1, MUC4 и MUC16, продуцируемые конъюнктивальными бокаловидными клетками. многослойные чешуйчатые клетки роговицы и конъюнктивы. Эти муцины образуют слой слезной пленки, наиболее близкий к поверхности эпителия роговицы и конъюнктивы, и, таким образом, играют важную защитную и гомеостатическую роль. Образование муцина слезной пленки может быть нарушено заболеванием поверхности глаза и, таким образом, может способствовать прогрессированию заболевания. Муцины продуцируются всеми влажными слизистыми оболочками тела, но лучше всего изучены муцины, продуцируемые дыхательными путями и желудочно-кишечным трактом. Обсуждались различия в типе муцина, функции, регуляции продукции и роли в заболевании роговицей/конъюнктивой, эпителием дыхательных путей и эпителием желудочно-кишечного тракта.
Обсуждались различия в типе муцина, функции, регуляции продукции и роли в заболевании роговицей/конъюнктивой, эпителием дыхательных путей и эпителием желудочно-кишечного тракта.
Meng и Kurose исследовали механизмы, с помощью которых афферентные сенсорные нервы роговицы регулируют выработку слезы. Чувствительные нервы роговицы образуют быстро реагирующую защитную систему, которая регулирует секрецию слезы. Несмотря на важность этих нервов, они крайне мало изучены. Стимуляция чувствительных нервов роговицы может вызвать боль или слезотечение. Сложная проводка для этого нервного рефлекса берет начало на поверхности глаза, соединяется через несколько уровней в мозге и затем нацелена на секреторные органы. В настоящем обзоре описано состояние современных знаний о множественных уровнях этого сложного нервного рефлекса и предложена потенциальная роль дисфункции нервного рефлекса или слезных желез при синдроме сухого глаза.
Манн и Тайг обратили внимание на взаимодействие контактных линз со слезной пленкой. В то время как ношение контактных линз может изменить большинство компонентов слезы, включая липиды, белки, муцины и электролиты, авторы утверждают, что изменения липидов слезной пленки и их отложение на контактных линзах могут иметь первостепенное значение, поскольку иммобилизация липидов повышает их восприимчивость к аутоокислительным процессам. деградация, которая, в свою очередь, может высвободить реактивные частицы, вызывающие дискомфорт. Авторы показывают, что белки могут по-разному откладываться на передней (например, кинин) и задней (например, витронектин) поверхности контактных линз, и это также может быть фактором, вызывающим дискомфорт от контактных линз. Исследования влияния ношения контактных линз на муцины на сегодняшний день не дали окончательных результатов. Авторы приходят к выводу, что нам необходимо проявлять больший интерес к подробной реакции человека на ношение контактных линз. С появлением более чувствительных биохимических и биофизических аналитических методов этот тип персонализированного анализа может достичь совершеннолетия.
В то время как ношение контактных линз может изменить большинство компонентов слезы, включая липиды, белки, муцины и электролиты, авторы утверждают, что изменения липидов слезной пленки и их отложение на контактных линзах могут иметь первостепенное значение, поскольку иммобилизация липидов повышает их восприимчивость к аутоокислительным процессам. деградация, которая, в свою очередь, может высвободить реактивные частицы, вызывающие дискомфорт. Авторы показывают, что белки могут по-разному откладываться на передней (например, кинин) и задней (например, витронектин) поверхности контактных линз, и это также может быть фактором, вызывающим дискомфорт от контактных линз. Исследования влияния ношения контактных линз на муцины на сегодняшний день не дали окончательных результатов. Авторы приходят к выводу, что нам необходимо проявлять больший интерес к подробной реакции человека на ношение контактных линз. С появлением более чувствительных биохимических и биофизических аналитических методов этот тип персонализированного анализа может достичь совершеннолетия.
Willcox изучил концепцию нормальной микробиоты глаза. Уровень культивируемых микробов с век, конъюнктивы и слез низкий, обычно <100 колониеобразующих единиц (КОЕ) в мазке со слизистой оболочки или <100 КОЕ/мкл в слезах. Это резко контрастирует с цифрами, которые можно выделить с поверхностей слизистых оболочек или слюны полости рта; 100 КОЕ/одна клетка слизистой оболочки языка и 10 7 –10 8 КОЕ/мкл слюны. Коагулазоотрицательные стафилококки, Propionibacterium sp. и Corynebacterium sp. являются наиболее распространенными бактериями, выращенными из конъюнктивы, век или слез. Ношение контактных линз может изменить микробиоту глаза, но эффект, по-видимому, зависит от продолжительности ношения линз, типа полимера или использования линз по определенному графику ношения (например, ежедневное или длительное ношение). С появлением проекта микробиома человека к поверхности глаза стали применяться методы микробной идентификации, не основанные на культуре.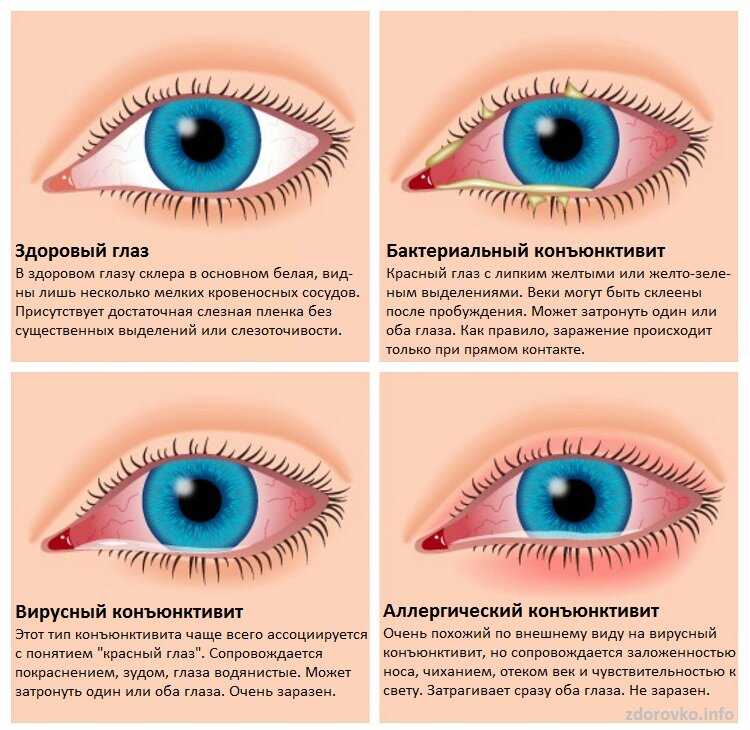 В настоящее время опубликовано лишь несколько примеров этого, но это область исследований.
В настоящее время опубликовано лишь несколько примеров этого, но это область исследований.
Leonardi исследовал медиаторы воспаления слезной жидкости, образующиеся при глазной аллергии. Хотя существуют клинические показатели для диагностики аллергического конъюнктивита, специфических маркеров для мониторинга прогрессирования заболевания или эффективности лечения не существует. Поскольку медиаторы, вырабатываемые во время болезни, сложны и многочисленны, могут быть полезны новые технологии, которые могут одновременно оценивать несколько соединений. Важно определить медиаторы воспаления, которые могут функционировать как биомаркеры для диагностики или измерения прогрессирования заболевания. Кроме того, эти медиаторы могут способствовать пониманию иммунных механизмов, играющих роль в глазной аллергии, и могут служить потенциальными мишенями для терапевтического вмешательства. Разработка лабораторных тестов для диагностики и мониторинга аллергического конъюнктивита является приоритетной задачей.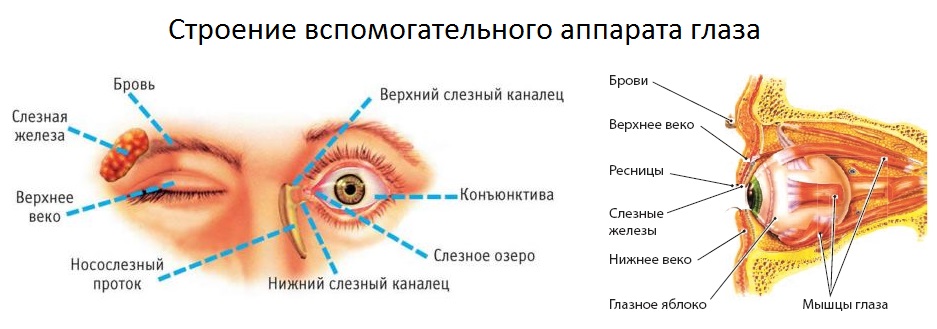
Pflugfleder и de Paiva рассмотрели роль врожденных воспалительных путей при синдроме сухого глаза. Современные методы лечения сухости глаз в основном паллиативные. Разработка методов лечения, нацеленных на врожденные воспалительные продукты, может иметь потенциал для лечения поверхностного компонента сухости глаз. Эта статья посвящена цитокинам, продуцируемым инфильтрирующими Т-клетками, и тому, как они изменяют нормальный баланс цитокинов. Выделенными цитокинами являются цитокин Th3 IL-13, цитокин Th2 IFNγ и цитокин Th27 IL-17. Терапия, нацеленная на эти три цитокина, имеет потенциал для лечения поверхностного компонента сухости глаз.
Hohenstein-Blaul, Funke и Grus исследовали текущее состояние слез как источника биомаркеров различных заболеваний, включая синдром сухого глаза (включая синдром Шегрена), глаукому, диабетическую ретинопатию и рак. Биомаркеры были обнаружены с использованием различных протеомных методов, многие из которых идеально подходят для использования со слезами, поскольку они требуют лишь небольших объемов образцов, но при этом генерируют информацию о многих различных белках. Имеются убедительные доказательства повышенных уровней цитокинов и белков молекулярного паттерна, связанных с повреждением, таких как белки S100 и другие, при синдроме сухого глаза. Было показано, что комбинации биомаркеров полезны для диагностики синдрома сухого глаза. Биомаркеры в слезах для рака молочной железы также включают S100A8 наряду с комплементом C1q и другими.
Имеются убедительные доказательства повышенных уровней цитокинов и белков молекулярного паттерна, связанных с повреждением, таких как белки S100 и другие, при синдроме сухого глаза. Было показано, что комбинации биомаркеров полезны для диагностики синдрома сухого глаза. Биомаркеры в слезах для рака молочной железы также включают S100A8 наряду с комплементом C1q и другими.
Джалберт изучил влияние питания на слезную пленку. Это область исследований, которой несколько пренебрегали. Известно, что питание важно для здоровья глаз (например, витамин А), но влияние диеты на слезную пленку вновь привлекло внимание лишь недавно. Изменения в диете были отмечены у пациентов с болезнью Шегрена, но споры о причинах и следствиях остаются. Утверждалось, что тяжелые симптомы сухости во рту, с которыми сталкиваются пациенты с болезнью Шегрена, могут влиять на их пищевые привычки. Имеются эпидемиологические данные о роли потребления омега-3 жирных кислот и предотвращении сухости глаз, и, хотя вероятно противовоспалительное действие, биохимическая основа этого неизвестна. Джалберт отмечает тот факт, что многие клинические испытания пищевых добавок не были оптимально спланированы, часто им не хватало контрольной группы плацебо, а также они были недостаточно мощными.
Джалберт отмечает тот факт, что многие клинические испытания пищевых добавок не были оптимально спланированы, часто им не хватало контрольной группы плацебо, а также они были недостаточно мощными.
Отказ от ответственности издателя: Это PDF-файл неотредактированной рукописи, которая была принята к публикации. В качестве услуги нашим клиентам мы предоставляем эту раннюю версию рукописи. Рукопись будет подвергнута редактированию, набору текста и рецензированию полученного доказательства, прежде чем она будет опубликована в ее окончательной цитируемой форме. Обратите внимание, что в процессе производства могут быть обнаружены ошибки, которые могут повлиять на содержание, и все правовые оговорки, применимые к журналу, относятся к нему.
Биохимия, слезная пленка — StatPearls
Введение
Слезная пленка покрывает поверхность глаза и необходима для защиты глаза от окружающей среды, смазывания поверхности глаза, поддержания гладкой поверхности для преломления света и сохранения здоровья глаза. конъюнктивы и аваскулярной роговицы. Слезная пленка имеет объем примерно от 3 до 10 мкл, толщину 3 мкм и секретируется со скоростью от 1 до 2 мкл/мин.[1][2] pH слез составляет примерно 7,45 и колеблется от 7,14 до 7,82, в зависимости от дневных и сезонных воздействий.[2] Длительное закрытие век, например, во время сна, приводит к накоплению углекислого газа, что снижает рН. Концептуально его можно рассматривать как имеющий три основных слоя: внутренний муциновый, средний водный и внешний липидный слой. Основные слезные железы производят большую часть водного слоя слезы, а небольшое количество — бокаловидными клетками конъюнктивы и добавочными слезными железами. Затем слезы испаряются или вытекают через слезные точки.
конъюнктивы и аваскулярной роговицы. Слезная пленка имеет объем примерно от 3 до 10 мкл, толщину 3 мкм и секретируется со скоростью от 1 до 2 мкл/мин.[1][2] pH слез составляет примерно 7,45 и колеблется от 7,14 до 7,82, в зависимости от дневных и сезонных воздействий.[2] Длительное закрытие век, например, во время сна, приводит к накоплению углекислого газа, что снижает рН. Концептуально его можно рассматривать как имеющий три основных слоя: внутренний муциновый, средний водный и внешний липидный слой. Основные слезные железы производят большую часть водного слоя слезы, а небольшое количество — бокаловидными клетками конъюнктивы и добавочными слезными железами. Затем слезы испаряются или вытекают через слезные точки.
Существует три различных типа слез, каждая из которых имеет уникальный биохимический состав. Базальные слезы обычно присутствуют на поверхности глаза, обеспечивая питательные вещества для поверхности глаза, поддерживая комфорт для глаз и избавляя поверхность от мусора.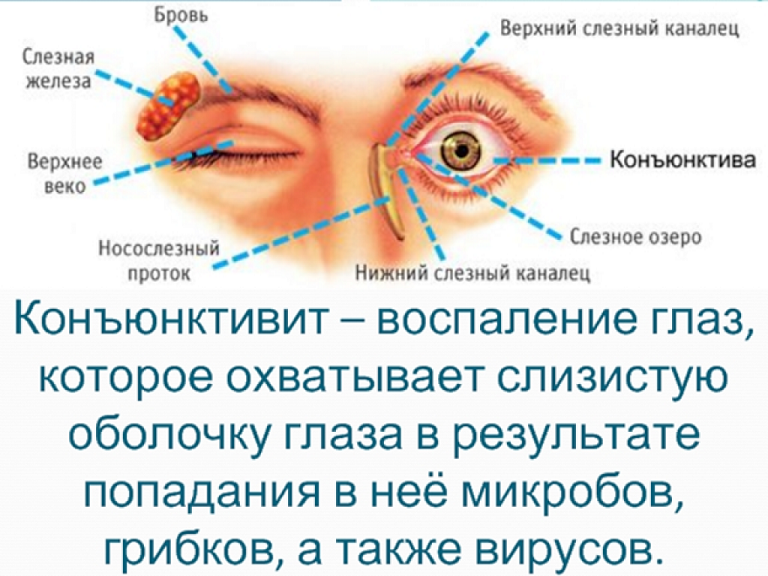 Рефлекторные слезы выделяются в ответ на раздражители, включая химические вещества и инородные тела. Рефлекторные слезы вырабатываются в большем количестве, чем базальные слезы, и участвуют в промывании поверхности глаза от раздражителей. Слезы закрытых глаз смазывают глаза во время сна. Некоторые компоненты слезной пленки, такие как лактоферрин, липокалин-1 и лизоцим, остаются относительно постоянными для разных типов слез.[1] Однако общее количество белка, липидов и секреторного IgA зависит от типа; содержание белка и липидов самое высокое в базальных слезах.[3] Несмотря на различия в составе, осмолярность типов слез остается относительно постоянной.[3]
Рефлекторные слезы выделяются в ответ на раздражители, включая химические вещества и инородные тела. Рефлекторные слезы вырабатываются в большем количестве, чем базальные слезы, и участвуют в промывании поверхности глаза от раздражителей. Слезы закрытых глаз смазывают глаза во время сна. Некоторые компоненты слезной пленки, такие как лактоферрин, липокалин-1 и лизоцим, остаются относительно постоянными для разных типов слез.[1] Однако общее количество белка, липидов и секреторного IgA зависит от типа; содержание белка и липидов самое высокое в базальных слезах.[3] Несмотря на различия в составе, осмолярность типов слез остается относительно постоянной.[3]
Основы
Слезная пленка неоднородна и классически делится на три отдельных слоя: внутренний муциновый, средний водный и внешний липидный слой. Хотя с практической точки зрения существует перекрытие и смешение слоев. Подавляющее большинство слезной пленки представляет собой водную фазу, содержащую различные концентрации муцина в зависимости от слоя и тонкий поверхностный липидный слой толщиной 50-100 нм. [1]
[1]
Внутренний слой образован муцинами, секретируемыми в основном бокаловидными клетками конъюнктивального эпителия и в меньшей степени ацинарными клетками слезной железы, эпителиальными клетками роговицы и конъюнктивы.[4] Он стабилизирует водный слой.[1] Они наиболее многочисленны в самом внутреннем слое слезы и уменьшаются в концентрации в более поверхностных слоях. Муциновый слой также содержит иммуноглобулины, мочевину, соли, глюкозу и белки.[5] Муцины прикрепляют водный слой к гидрофобному эпителию роговицы через гликокаликс, способствуя равномерному смазыванию поверхности глаза. Кроме того, они снижают поверхностное натяжение и повышают стабильность слезной пленки.[5]
Водный слой необходим для поддержания смазки и защиты поверхности глаза. Он содержит белки, метаболиты, неорганические соли, глюкозу, кислород и электролиты (магний, бикарбонат, кальций, мочевина), необходимые для поддержания здоровья поверхности глаза, а также для вымывания мусора и токсинов.[1][5]
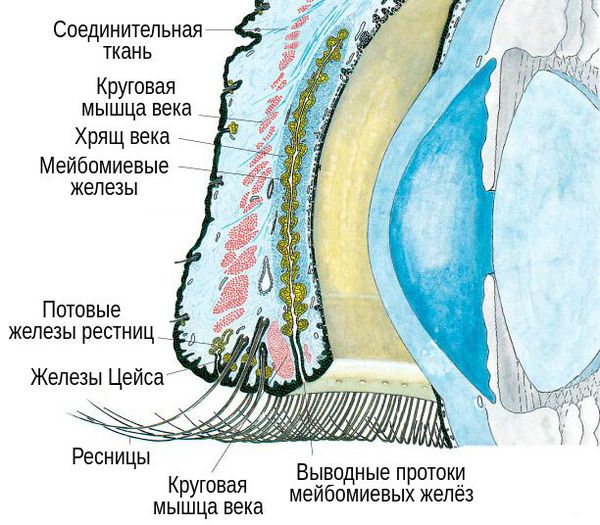
Липидный слой существует на границе раздела окружающей среды и слезы и необходим для замедления скорости испарения слезы.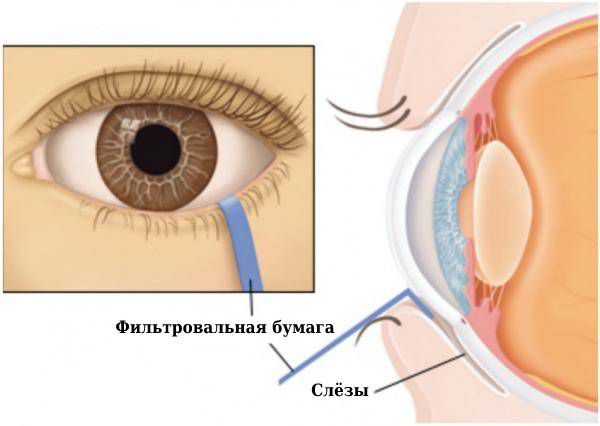 Этот поверхностный липидный слой содержит холестерин, восковые эфиры, жирные кислоты и фосфолипиды. В слезах было идентифицировано более 600 уникальных липидов из 17 различных классов липидов.[1][6] Большая часть этих липидов вырабатывается мейбомиевыми железами, которые выстилают края век. В частности, мейбум содержит как полярные, так и неполярные липиды. Полярный компонент служит поверхностно-активным веществом и в основном состоит из фосфолипидов, фосфатидилхолина и сфингомиелина. Этот слой состоит в основном из холестерина и сложных эфиров воска.
Этот поверхностный липидный слой содержит холестерин, восковые эфиры, жирные кислоты и фосфолипиды. В слезах было идентифицировано более 600 уникальных липидов из 17 различных классов липидов.[1][6] Большая часть этих липидов вырабатывается мейбомиевыми железами, которые выстилают края век. В частности, мейбум содержит как полярные, так и неполярные липиды. Полярный компонент служит поверхностно-активным веществом и в основном состоит из фосфолипидов, фосфатидилхолина и сфингомиелина. Этот слой состоит в основном из холестерина и сложных эфиров воска.
Молекулярный
Роговица содержит большое количество плотных соединений для предотвращения трансцеллюлярной проницаемости, что позволяет прозрачной и бессосудистой структуре сохранять свою клеточную архитектуру и предотвращать ангиогенез, воспаление и клеточную инфильтрацию.[4] Напротив, конъюнктива содержит проницаемые плотные соединения, сильно васкуляризирована и содержит многослойные чешуйчатые клетки и бокаловидные клетки, необходимые для ответа на глазные повреждения.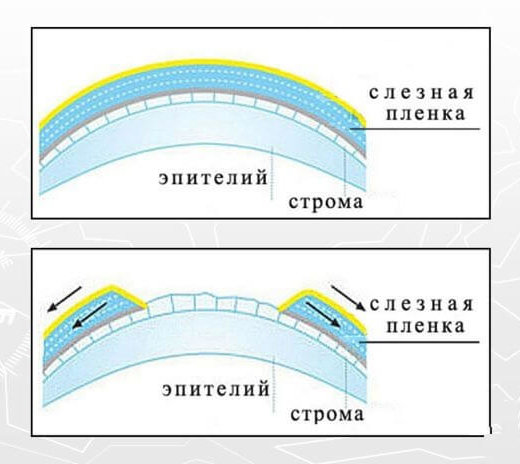
Многочисленные клетки участвуют в поддержании гомеостаза слезной пленки и реагировании на возмущения. Например, как указывалось ранее, муцины продуцируются ацинарными клетками слезной железы, эпителиальными клетками роговицы и конъюнктивы и бокаловидными клетками конъюнктивы.[4] При глазной аллергии эпителиальные клетки конъюнктивы выделяют цитокины и тучные клетки, присутствующие в веках, а конъюнктива выделяет гистамин и факторы воспаления.[7] Раздражение глазной поверхности, например, при синдроме сухого глаза, приводит к активации воспалительного каскада, высвобождению цитокинов и привлечению антигенпрезентирующих клеток и хелперных Т-клеток Th2.[7]
Большинство белков слезной пленки синтезируются и секретируются локально слезной железой; однако некоторые белковые компоненты могут попадать в слезную жидкость из системного кровообращения.[8] Белки, в том числе лактоферрин, лизоцим и специфичный для слезы преальбумин, являются ключевыми компонентами слезной пленки, но практически отсутствуют в сыворотке [8]. Таким образом, белки, такие как лизоцим, использовались в качестве маркера функции слезной железы и, таким образом, маркера нарушений слезной пленки, таких как синдром сухого глаза. Иммуноглобулины аналогичным образом синтезируются локально плазматическими клетками глаза.[8] Первичный иммуноглобулин, обнаруживаемый в слезной пленке, представляет собой секреторный IgA в количестве от 10 до 80 мг на децилитр; IgG и IgE присутствуют в гораздо более низких концентрациях. [2] [5] [9].] Секреторный IgA синтезируется как конъюнктивой, так и слезной железой, что объясняет его высокую концентрацию в слезах по сравнению с сывороткой.
Таким образом, белки, такие как лизоцим, использовались в качестве маркера функции слезной железы и, таким образом, маркера нарушений слезной пленки, таких как синдром сухого глаза. Иммуноглобулины аналогичным образом синтезируются локально плазматическими клетками глаза.[8] Первичный иммуноглобулин, обнаруживаемый в слезной пленке, представляет собой секреторный IgA в количестве от 10 до 80 мг на децилитр; IgG и IgE присутствуют в гораздо более низких концентрациях. [2] [5] [9].] Секреторный IgA синтезируется как конъюнктивой, так и слезной железой, что объясняет его высокую концентрацию в слезах по сравнению с сывороткой.
Функция
Функции слезной пленки включают обеспечение смазки поверхности глаза и века, антимикробную защиту, обеспечение гладкой поверхности глаза для преломления и снабжение кислородом и питанием бессосудистого эпителия роговицы.
Слезная пленка образует защитный барьер между поверхностью глаза и внешней средой и обладает антимикробными свойствами.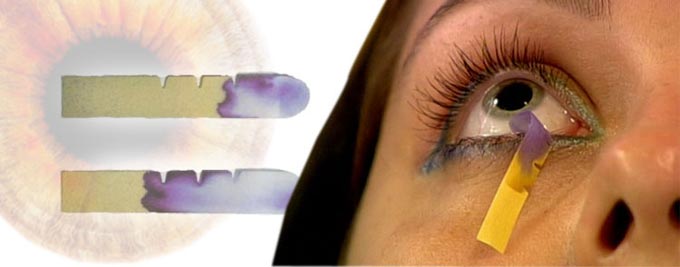 Ключевые антимикробные факторы, обнаруженные в слезной пленке, включают лизоцим, лактоферрин, трансферрин, церулоплазмин, IgA, IgG, IgE, комплемент, гликопротеин и антипротеиназу, которые находятся в водном слое слезной пленки.
Ключевые антимикробные факторы, обнаруженные в слезной пленке, включают лизоцим, лактоферрин, трансферрин, церулоплазмин, IgA, IgG, IgE, комплемент, гликопротеин и антипротеиназу, которые находятся в водном слое слезной пленки.
Лизоцим оказывает бактериолитическое действие, гидролизуя клеточные стенки бактериального пептидогликана. Его самая высокая концентрация в слезах по сравнению с другими жидкостями организма. Лактоферрин хелатирует железо, изолируя его от бактерий, которым оно требуется для метаболизма и роста.[2] Иммуноглобулины играют ключевую роль в защите от бактериальных, вирусных и паразитарных инфекций. Уровни IgA повышаются при инфекционных или воспалительных состояниях, включая острый бактериальный конъюнктивит, блефароконъюнктивит и острый кератоконъюнктивит, кератомаляцию и реакцию трансплантата роговицы.] альфа-лизин — еще одно антимикробное вещество, обнаруженное в слезах, и оно вызывает разрыв клеток.[5]
Муцины и гликопротеины, секретируемые бокаловидными клетками, также играют роль в защите глаз, имея рецепторы-ловушки для бактерий, тем самым предотвращая прикрепление к ткани глаза, а также захват бактерий или инородных тел. [1][5] Кроме того, они концентрируют IgA на поверхности слизистой оболочки, где могут присутствовать бактерии.[5]
[1][5] Кроме того, они концентрируют IgA на поверхности слизистой оболочки, где могут присутствовать бактерии.[5]
Механизм
Сенсорная иннервация играет ключевую роль в регуляции слезопродукции. Афферентные нейроны тройничного нерва (V1) в роговице и веках получают сенсорные сигналы в ответ на изменения температуры и вредные стимулы через механорецепторы, полимодальные рецепторы и холодовые рецепторы. В ответ они активируют вегетативные и соматические рефлексы, в том числе повышенное слезоотделение и моргание.[10]
Слезные и мейбомиевы железы, отвечающие за выработку водного и липидного слоев слезной пленки соответственно, получают как симпатическую, так и парасимпатическую иннервацию. Вместе они образуют нейронную цепь, которая регулирует секрецию слезы. Парасимпатическая активация в ответ на боль, раздражение и холод приводит к увеличению продукции воды и муцина, а также продукции слезы. Симпатические входы приводят к увеличению секреции эпителиальных клеток конъюнктивы.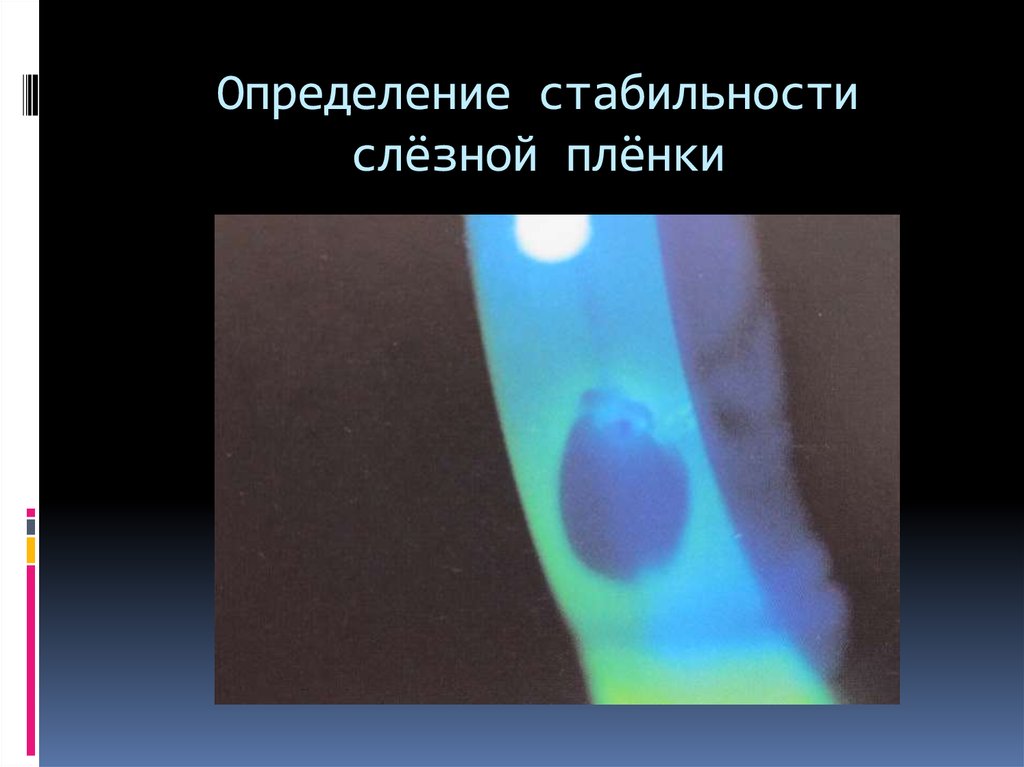 [10]
[10]
Тестирование
Время разрыва слезы (TBUT) — это измерение, используемое для оценки стабильности слезной пленки, проводимое при осмотре с помощью щелевой лампы после закапывания флуоресцеина. Снижение TBUT (определяемое как <10 секунд) считается ненормальным и часто наблюдается при синдроме испарения сухого глаза.
Осмолярность слезы можно использовать в качестве индикатора стабильности слезной пленки. Осмолярность колеблется от 300 до 310 мОсм/кг в нормальных глазах и может достигать 360 мОсм/кг при сухости глаз.[11] Гиперосмолярность слезы возникает в результате неадекватной продукции слезы или повышенного оборота и испарения слезы. Длительная гиперосмолярность слезы связана с выработкой медиаторов воспаления (IL-1β, TNF-α и MMP-9).) и цитокинов, а также активацию путей провоспалительной митоген-активируемой протеинкиназы (MAP-K), которые могут повредить поверхность роговицы и бокаловидные клетки.[12][13] Активация путей MAP-K приводит к дальнейшей продукции воспалительных цитокинов и матриксных металлопротеиназ.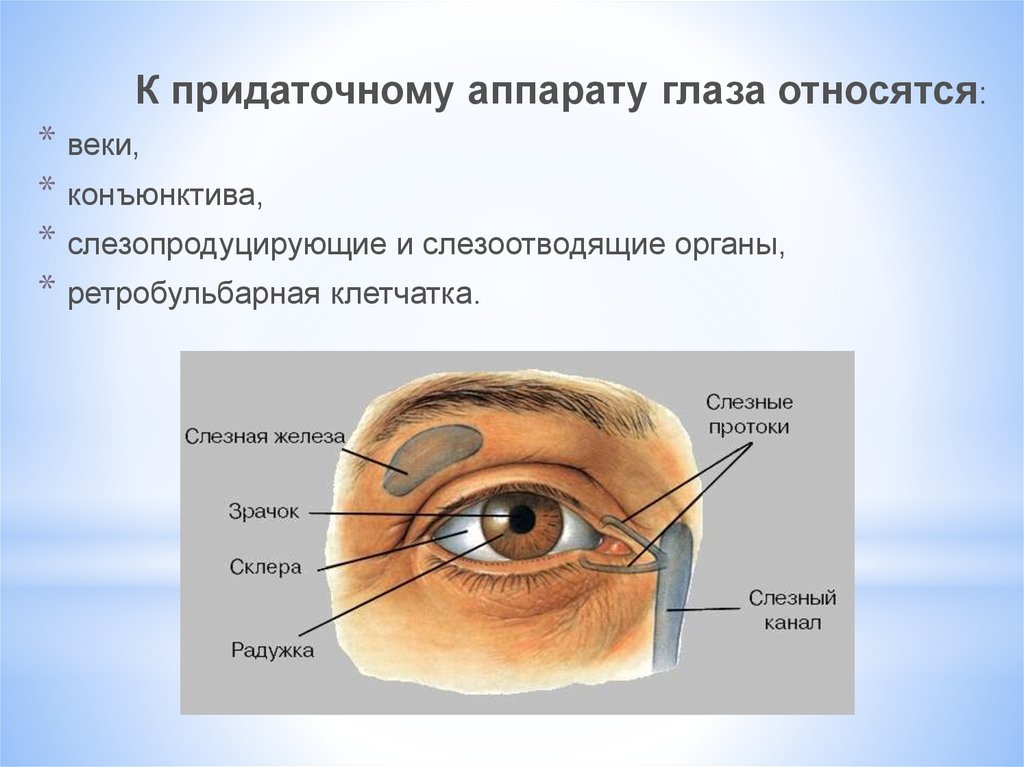
Окрашивание поверхности глаза флуоресцеином, лиссаминовым зеленым и бенгальской розой можно использовать для визуализации дефектов поверхности роговицы, а также дегенерированных и мертвых клеток. Объем слез можно оценить с помощью теста Ширмера, который измеряет выработку слезы с течением времени. В тесте Ширмера полоска помещается внутрь нижнего века и измеряется количество смачивания слезами. Еще одним методом оценки объема слезы является осмотр слезного мениска. Измерение воспалительных биомаркеров (таких как матриксные металлопротеиназы, лизоцим и лактоферрин) позволяет оценить степень воспаления глаза и аномалии слезной пленки.
Клиническое значение
Аномалии биомаркеров слезной пленки могут отражать длительный метаболический сбой или болезненные состояния как на поверхности глаза, так и на системные заболевания. Однако нарушение регуляции компонентов слезы также может наблюдаться после операций на глазах, инфекций и использования контактных линз. Аномальные концентрации белков и медиаторов воспаления в слезной пленке наблюдались при глаукоме, диабетической ретинопатии, болезни мейбомиевых желез, птеригиуме, кератоконусе, аутоиммунных заболеваниях щитовидной железы, диабете и даже системном раке. [1][14] Поскольку слезная пленка отражает среду глаза и легкодоступна для неинвазивного сбора и анализа, ее можно использовать для дальнейшего выяснения процессов заболевания или мониторинга прогрессирования заболевания. Несколько примеров обсуждаются ниже.
[1][14] Поскольку слезная пленка отражает среду глаза и легкодоступна для неинвазивного сбора и анализа, ее можно использовать для дальнейшего выяснения процессов заболевания или мониторинга прогрессирования заболевания. Несколько примеров обсуждаются ниже.
Исследования показали увеличение провоспалительных цитокинов при синдроме сухого глаза, включая ИЛ-1, ИЛ-6, ИЛ-8 и ФНО-альфа.[15] Эти медиаторы воспаления в настоящее время являются мишенью для нескольких местных препаратов, включая циклоспорин 0,05%, циклоспорин 0,09% и лифитеграст 5%. Точный механизм действия этих препаратов неизвестен. Известно, что циклоспорин ингибирует кальцинейрин, тем самым ингибируя транскрипцию ИЛ-2 и блокируя воспалительный каскад. Также было показано, что он увеличивает выработку слезы и увеличивает плотность бокаловидных клеток, что приводит к улучшению муцинового слоя.[16] Точно так же было показано, что лифитеграст увеличивает выработку слезы и увеличивает плотность бокаловидных клеток, хотя последнее было продемонстрировано только на мышах.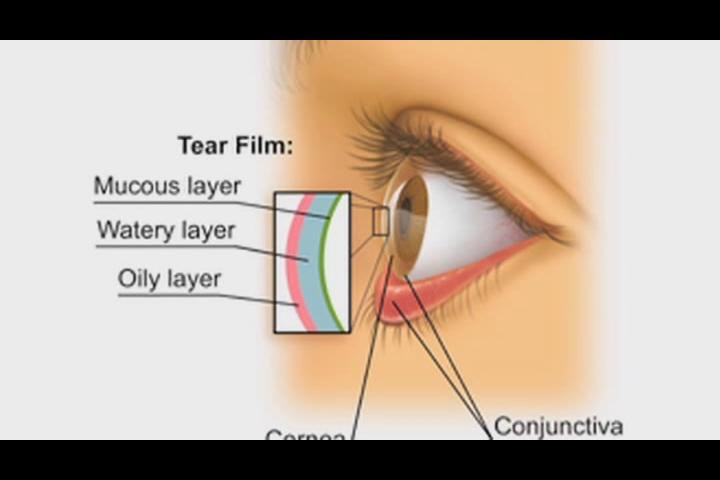 Кроме того, у пациентов с синдромом сухого глаза низкий уровень слезного лактоферрина и лизоцима, оба из которых вырабатываются слезной железой.[18] Таким образом, эти факторы могут быть использованы для оценки степени функции слезной железы и секреторной функции слезы, независимо от лежащей в основе этиологии синдрома сухого глаза.
Кроме того, у пациентов с синдромом сухого глаза низкий уровень слезного лактоферрина и лизоцима, оба из которых вырабатываются слезной железой.[18] Таким образом, эти факторы могут быть использованы для оценки степени функции слезной железы и секреторной функции слезы, независимо от лежащей в основе этиологии синдрома сухого глаза.
Исследования показали увеличение провоспалительных цитокинов IL-1β, IL-6, IL-12, TNF-α в слезах пациентов, проходящих лечение глаукомы.[14] У пациентов с диабетической ретинопатией также наблюдается повышенный уровень провоспалительных цитокинов (IP-10, MCP-10), сниженный уровень антиангиогенных факторов и аномалии белкового состава слезы.[14] Слезная жидкость у пациентов с синдромом Шегрена показала присутствие анти-Ro/SSA и анти-La/SSB антител, которые коррелируют с тяжестью кератоконъюнктивита Sicca [14].
Аномалии слезной пленки наблюдаются при глазной реакции «трансплантат против хозяина» после аллогенной трансплантации гемопоэтических стволовых клеток, характеризующейся выраженной сухостью глаз и поражением поверхности глаза. В слезной пленке у этих пациентов и у большинства пациентов с сухостью глаз обнаруживаются повышенные уровни ИЛ-2, ИЛ-10, ИЛ-17α, ИНФ-g, ФНО-α и ИЛ-6 [19].
В слезной пленке у этих пациентов и у большинства пациентов с сухостью глаз обнаруживаются повышенные уровни ИЛ-2, ИЛ-10, ИЛ-17α, ИНФ-g, ФНО-α и ИЛ-6 [19].
Провоспалительные медиаторы также увеличиваются в слезной пленке при неоваскуляризации роговицы (CNV). ХНВ представляет собой образование новых сосудистых структур на роговице и может вызвать помутнение роговицы и потерю зрения. Исследования показали, что у взрослых слезная пленка людей с CNV имеет более высокие уровни проангиогенных факторов IL-6, IL-8 и VEGF по сравнению с контрольной группой без CNV. Кроме того, наблюдалась сильная корреляция между уровнями цитокинов IL-6, MCP-1 и VEGF в слезах людей с ХНВ [20].
Несмотря на то, что здесь были включены только несколько болезненных состояний и связанная с ними слезная пленка, аналогичные характеристики характерны и для других глазных поверхностных и системных заболеваний. Дальнейшая характеристика слезной пленки при различных заболеваниях может идентифицировать специфические для заболевания биомаркеры для выяснения этиологии, патогенеза и новых целей лечения.
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Dartt DA, Willcox MD. Сложность слезной пленки: значение для гомеостаза и дисфункции во время болезни. Эксп. Разр. 2013 дек; 117:1-3. [Бесплатная статья PMC: PMC4225770] [PubMed: 24280033]
- 2.
Van Haeringen NJ. Клиническая биохимия слез. Сурв Офтальмол. 1981 сен-октябрь; 26(2):84-96. [PubMed: 7034254]
- 3.
Фу Р., Клиннгам В., Хеур М., Эдман М.С., Хамм-Альварес С.Ф. Слезные протеазы и ингибиторы протеаз: потенциальные биомаркеры и факторы, вызывающие заболевание глазной поверхности. Контактные линзы для глаз. 2020 март; 46 Приложение 2 (Приложение 2): S70-S83. [Бесплатная статья PMC: PMC6992486] [PubMed: 31369467]
- 4.
Ходжес Р.Р., Дартт Д.А. Муцины слезной пленки: передовые защитники глазной поверхности; по сравнению с муцинами дыхательных путей и желудочно-кишечного тракта.
 Эксп. Разр. 2013 Декабрь; 117: 62-78. [Бесплатная статья PMC: PMC4222248] [PubMed: 23954166]
Эксп. Разр. 2013 Декабрь; 117: 62-78. [Бесплатная статья PMC: PMC4222248] [PubMed: 23954166]- 5.
Дэвидсон Х.Дж., Куонен В.Дж. Слезная пленка и глазные муцины. Вет офтальмол. 2004 март-апрель;7(2):71-7. [Бесплатная статья PMC: PMC7169288] [PubMed: 14982585]
- 6.
Лам С.М., Тонг Л., Дуан Х., Петцник А., Венк М.Р., Шуй Г. Обширная характеристика слезной жидкости человека, собранная с использованием различных методов, выявила наличие новых липидных амфифилов. J липидный рез. 2014 фев; 55 (2): 289-98. [Бесплатная статья PMC: PMC3886667] [PubMed: 24287120]
- 7.
Lu Q, Yin H, Grant MP, Elisseeff JH. Модель in vitro для поверхности глаза и системы слезной пленки. Научный представитель 2017 г. 21 июля; 7 (1): 6163. [Бесплатная статья PMC: PMC5522434] [PubMed: 28733649]
- 8.
Janssen PT, van Bijsterveld OP. Происхождение и биосинтез белков слезной жидкости человека. Invest Ophthalmol Vis Sci.
 1983 г., май; 24(5):623-30. [PubMed: 6841010]
1983 г., май; 24(5):623-30. [PubMed: 6841010]- 9.
Сен Д.К., Зарин Г.С. Концентрация иммуноглобулинов в слезах человека при глазных заболеваниях. Бр Дж Офтальмол. 1979 г., май; 63 (5): 297–300. [Статья бесплатно PMC: PMC1043475] [PubMed: 465402]
- 10.
Meng ID, Kurose M. Роль афферентных нейронов роговицы в регуляции слез в норме и при сухости глаз. Эксп. Разр. 2013 дек;117:79-87. [Статья бесплатно PMC: PMC3989072] [PubMed: 23994439]
- 11.
Liu H, Begley C, Chen M, Bradley A, Bonanno J, McNamara NA, Nelson JD, Simpson T. Связь между нестабильностью разрыва и гиперосмолярность при синдроме сухого глаза. Invest Ophthalmol Vis Sci. 2009 авг; 50 (8): 3671-9. [PubMed: 19324847]
- 12.
Луо Л., Ли Д.К., Доши А., Фарли В., Корралес Р.М., Пфлюгфельдер СК. Экспериментальная сухость глаз стимулирует выработку воспалительных цитокинов и MMP-9 и активирует сигнальные пути MAPK на поверхности глаза.
 Invest Ophthalmol Vis Sci. 2004 Декабрь; 45 (12): 4293-301. [PubMed: 15557435]
Invest Ophthalmol Vis Sci. 2004 Декабрь; 45 (12): 4293-301. [PubMed: 15557435]- 13.
Абушарха А.А., АльШехри ТМ, Хаками А.Ю., Альсакр А.М., Фагехи Р.А., Аланази С.А., Масмали А.М. Анализ базальной и рефлекторной осмолярности слезы человека у здоровых людей: оценка осмолярности слезы. The Adv Ophthalmol. 2018 янв-декабрь;10:2515841418794886. [Бесплатная статья PMC: PMC6104209] [PubMed: 30151502]
- 14.
von Thun Und Hohenstein-Blaul N, Funke S, Grus FH. Слезы как источник биомаркеров глазных и системных заболеваний. Эксп. Разр. 2013 Декабрь; 117: 126-37. [В паблике: 23880526]
- 15.
Massingale ML, Li X, Vallabhajosyula M, Chen D, Wei Y, Asbell PA. Анализ воспалительных цитокинов в слезах пациентов с синдромом сухого глаза. Роговица. 2009 окт; 28 (9): 1023-7. [PubMed: 19724208]
- 16.
Салл К., Стивенсон О.Д., Мундорф Т.К., Рейс Б.Л. Два многоцентровых рандомизированных исследования эффективности и безопасности офтальмологической эмульсии циклоспорина при синдроме сухого глаза средней и тяжелой степени.
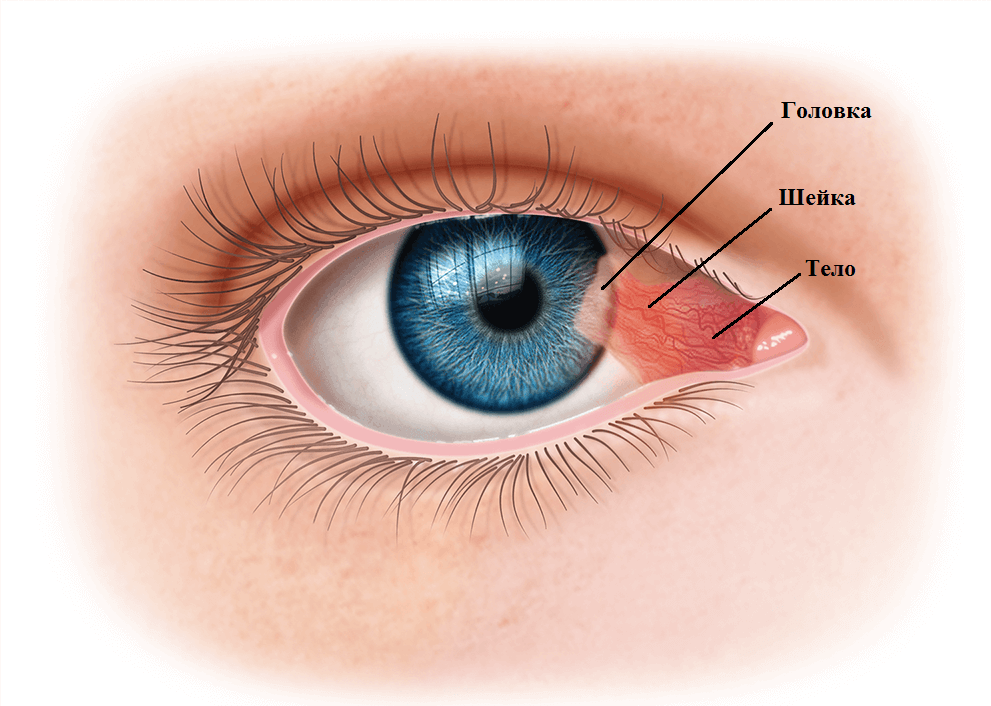 Исследовательская группа CsA Phase 3. Офтальмология. 2000 апрель; 107 (4): 631-9. [PubMed: 10768324]
Исследовательская группа CsA Phase 3. Офтальмология. 2000 апрель; 107 (4): 631-9. [PubMed: 10768324]- 17.
Гимарайнш де Соуза Р., Ю З., Стерн М.Е., Пфлюгфельдер СК, де Пайва КС. Подавление Th2-опосредованного кератоконъюнктивита Sicca с помощью Lifitegrast. J Ocul Pharmacol Ther. 2018 сен; 34 (7): 543-549. [Бесплатная статья PMC: PMC6909696] [PubMed: 29958030]
- 18.
Danjo Y, Lee M, Horimoto K, Hamano T. Повреждение поверхности глаза и лактоферрин слезы при синдроме сухого глаза. Acta Ophthalmol (Копенг). 1994 г., август 72(4):433-7. [В паблике: 7825407]
- 19.
Jung JW, Han SJ, Song MK, Kim TI, Kim EK, Min YH, Cheong JW, Seo KY. Цитокины слезы как биомаркеры хронической болезни «трансплантат против хозяина». Трансплантация костного мозга Биол. 2015 декабря; 21 (12): 2079-2085. [PubMed: 26303101]
- 20.
Zakaria N, Van Grasdorff S, Wouters K, Rozema J, Koppen C, Lion E, Cools N, Berneman Z, Tassignon MJ.

Written by admin
- Лечение тонзиллита: выбор антибиотика при обострении, симптомы и современные методы терапии
- Что умеет ребенок в 3 месяца: развитие, навыки и уход за малышом
- Кисломолочные смеси для новорожденных: польза, виды, применение
- Почему грудничок плохо спит ночью: причины и решения
- Развитие фонематического слуха у детей: эффективные методы и упражнения
