1.3 Лекарственные пленки как прогрессивное средство лечения ожогов. Пленки полимерные лекарственные
Полимерные пленочные фармацевтические средства - Справочник химика 21
из "Капсулирование в полимерных пленках"
Широкое применение в медицине находят пленочные формы лекарственных препаратов на полимерной основе. Разработке новых лекарственных форм посвящена часть медицинской науки - фармация, интенсивно развивающаяся в последние годы благодаря использованию технологии переработки в пленки и листы композиций высокомолекулярных соединений и лекарственных веществ, микро- и макрокапсулирования лекарств, конструирования разнообразных пленочных устройств для введения лекарств в организм человека или животного. Природные высокомолекулярные соединения и синтетические полимеры используют в новых фармацевтических средствах для капсулирования лекарственных веществ в целях защиты от атмосферных воздействий при хранении и регулирования скорости введения в организм при применении. Приемы капсулирования веществ, используемые в фармакологии, разнообразны и, в частности, включают те, которые рассмотрены нами в гл. 1 и 2. Необходимость защиты лекарственных веществ от окружающей среды кроме общих причин обусловлена спецификой их использования. В организме человека при перо-ральном применении лекарственное вещество проходит зоны с различными кислотностью, ферментативной активностью и концентрацией солей, что может привести к преждевременному разложению или значительному снижению фармакологического эффекта от лекарственного препарата. Стремление разработчиков новых лекарственных форм уменьшить скорость растворения лекарственного вещества обусловлено необходимостью создания постоянной оптимальной концентрации вещества в крови или других жидких средах организма и увеличения интервалов времени между приемами препаратов до суток или величины, кратной суткам. Многократный прием лекарственных веществ в течение суток без регулятора скорости растворения неудобен больным и может привести к возникновению чрезмерных концентраций лекарственного вещества, что связано с риском появления побочных явлений. [c.161] В основу классификации новых полимерных фармацевтических средств положены два признака - способ применения и их строение. По способу применения полимерные фармацевтические средства подразделяют на формы перорального, наружного и подкожного введения. По устройству или структуре формы различного назначения разделяют на лекарственные композиции в полимерной оболочке, полимерные лекарственные формы с полимерным каркасом и лекарственные композиции в полимерном каркасе, покрытые защитной оболочкой [148]. К традиционным формам перорального применения относятся таблетки, пилюли, к формам наружного применения -пластыри, офтальмологические средства, подкожного - имплантанты. Рассмотрим особенности строения некоторых запатентованных в европейских странах и США лекарственных форм по способам их применения. [c.162] Отличие действия полимерной матричной таблетки от действия препарата в форме традиционной таблетки иллюстрируется зависимостью количества лекарственного вещества, поступающего в кровь человека, от времени после перорального приема таблеток (рис. 4.6). Изображенная на рисунке матричная таблетка получена формованием суспензии аспирина в 10%-м растворе триацетата целлюлозы. Размеры частиц лекарственного препарата не позволяют использовать фильеры для прямого формования суспензии, поэтому таблетку, согласно [151], получают следующим образом. На антиадгезионную поверхность наносят слой частиц аспирина, на аспирин с помощью фильеры наносят раствор триацетата целлюлозы или этилцеллюлозы, опудривают тальком и порошком стеариновой кислоты, затем сушат и вновь укладывают слой частиц аспирина. Вместо стеариновой лслоты можно использовать любой нетоксичный порошок, например стеарат кальция, линолевую или пальмитиновую кислоты [151]. От соотношения компонентов, толщины слоя и размера частиц аспирина или другого лекарственного вещества зависит время выделения или пролонгированного действия лекарственного вещества матричной таблетки. [c.163] Тип матричной таблетки определяется механизмом высвобождения из нее лекарственного вещества и характером разрушения таблетки в средах живого организма. Различают матричные таблетки с жестким и пластичным каркасом, имеющим открытую капиллярную структуру, и матричные таблетки с ячеистой структурой. В таблетках этих двух типов частицы лекарственного вещества защищены от газообразной среды полностью, но при погружении в жидкость (воду) вследствие растворения специальных низкомолекулярных компонентов становятся доступными для вымывания. В таблетках третьего типа лекарственное вещество капсулировано в полимерной пленке таким образом, что каждая частица находится в замкнутой ячейке, стенки которой проницаемы для воды, но непроницаемы для лекарственного вещества. Рассмотрим подробнее механизм высвобождения лекарственных веществ из матричных таблеток разных типов. [c.164] Более интенсивное, полное и равномерное извлечение лекарственного вещества происходит из матричных таблеток с пластичным каркасом. Для приготовления таблеток с пластичным каркасом вместо синтетических термопластов используют пластичные и легкоплавкие высокомолекулярные вещества природного происхождения, прочность и формоустойчивость которых увеличивают волокнистым наполнителем [152]. [c.165] Механизм и скорость высвобождения лекарства из пленок являются главными характеристиками капсулированных препаратов всех рассмотренных типов. Механизм высвобождения капсулированного вещества из пленки в основном определяет кинетические закономерности процесса декапсулирования, однако абсолютная скорость высвобождения основного лекарственного компонента может быть существенно изменена различными технологическими приемами, не изменяющими типа лекарственной формы и механизма. ее превращений в организме человека или животного. Изучению механизма и кинетики высвобождения лекарственных веществ из матричных таблеток каркасного типа посвящено множество экспериментальных работ. Так, на примере пленок, полученных поливом растворов гидрофильных полимеров, содержащих твердую дисперсию клофелина, изучали скорость высвобождения лекарственного вещества в модельную водную среду [156]. Установлено, что скорость выделения клофелина величина переменная, пропорциональная квадратному корню из времени эксперимента (рис. 4.9). Такое изменение скорости выделения вещества из полимерной матрицы свидетельствует о диффузионном механизме декапсулирования. Диффузионное высвобождение веществ из нерастворимых в воде гидрофильных пленок обеспечивает пролонгированное введение лекарственных препаратов в организм. [c.167] Скорость высвобождения лекарственных веществ из матричных таблеток регулируют путем предварительного микрокапсулирования частиц лекарственных веществ перед введением в пленки или таблетки. Процесс диффузии лекарственного вещества сквозь оболочки отдельных микрокапсул лимитирует скорость его выделения из матричной таблетки в организм больного. Барьерные свойства оболочек микрокапсул пропорциональны их толщине, оцениваемой в экспериментальных работах [157] по соотношению массы ядра и оболочки (табл. 4.3). [c.167] Константа скорости растворения. [c.168] Варьируя соотношение масс частиц лекарственных веществ и оболочек микрокапсул, состав формуемой композиции, способ и режим формования, можно изменять в широких пределах скорость высвобождения веществ из таблеток, длительность поддержания в крови больного постоянной и оптимальной концентрации лекарств. [c.168] Малочисленной среди рассмотренных выше матричных таблеток каркасного типа выглядит группа фармацевтических средств, принцип действия которь1х основан на явлении осмоса. Матричные таблетки данного типа отличаются ячеистой структурой, причем ячейки не содержат характерных для каркасных таблеток микротрещин и пор, облегчающих доступ воды к частицам лекарственных веществ. Стенки ячеек хотя и тонки (до 0,5- 1 мкм), но непроницаемы для молекул лекарственного вещества. Полимерная основа нерастворима в воде, но достаточно проницаема для воды. [c.168] Оценку кинетики выделения лекарственных препаратов из пленочных форм проводят в модельных экспериментах. Это позволяет приблизительно учесть рецептурные, технологические и другие факторы, определяющие скорость поступления лекарственного вещества в организм человека или животного. Однако каждый человек имеет индивидуальные физиологические особенности, существенно влияющие на эффективность применения пленочных препаратов. Экспериментально установлено, что пленочные фармацевтические средства, введенные различным людям в полость рта рассасываются с разной скоростью, определяющейся особенностями отделения слюны, pH слюны и локальной температурой [159]. Для учета индивидуальных особенностей человека перед введением в полость рта пленочных лекарственных форм, например содержащих нитроглицерин, пациенту приклеивают на десну пробную пленку из полимерной композиции без лекарственного препарата и измеряют время ее полного рассасывания. Определив время рассасывания пленки-носителя, терапевт, зная фармокинетику нитроглицерина и его необходимую концентрацию в крови, выбирает из набора пленочных средств, содержащих различное количество капсулированного препарата, такую пленку, которая обеспечит необходимую скорость поступления нитроглицерина в организм конкретного пациента. Предложенный метод позволяет строго индивидуально дозировать препарат в кровь больных и получать оптимальный лечебный эффект. [c.169] Пластыри. Пластырь - древнейшая лекарственная форма наружного применения. Фирмы Японии, США, ФРГ совершенствуют составы и устройства пластырей, широко используя синтетические полимеры и технологию капсулирования лекарственных веществ в пленках. [c.169] Имплантанты. Пленочные имплантанты предназначены для подкожного введения лекарственных веществ и гормональных препаратов животным, но могут быть использованы при лечении некоторых заболеваний человека. Способ применения и структура пленочного имплантанта иллюстрирует рис. 4.13. Имплантанты получают методом формования дисперсий капсулируемых веществ в растворах пленкообразующих полимеров, так как многие препараты нетермостабильны при температуре переработки расплавов термопластов. В качестве термопластов выбирают полимеры, не растворимые в воде и не подвергающиеся биодеградации в тканях живого организма. Полимер, образующий Пленку для подкожного введения, должен быть эластичным и гидрофобным. В качестве примера рассмотрим запатентованный в США способ получения имплантанта из полиэтилена и его свойства [164]. [c.172] Создание имплантантов, равномерно выделяющих лекарственные препараты в организм, является сложной технологической задачей, в рещении которой большое значение имеет учет всех факторов, влияющих на скорость диффузии низкомолекулярных веществ из полимерных матриц ячеистой структуры. [c.173] Офтальмологические средства. При лечении глазных болезней применение лекарственных форм пролонгированного действия имеет особенно важное значение. В отличие от пластырей и форм перорального применения больной часто не может самостоятельно наносить лекарственный препарат на слизистую оболочку без помощи медицинского персонала и поэтому время действия лекарственных средств в офтальмологии должно превышать интервал времени между приемами больных у врача. Пленки с капсулированными лекарствами изготавливают в виде плоских дисков, которые вводят за веко и размещают на слизистой оболочке глаза (рис. 4.15). [c.173]Вернуться к основной статье
chem21.info
1.3 Лекарственные пленки как прогрессивное средство лечения ожогов. Технология получения лекарственных пленок для лечения термических ожогов
Похожие главы из других работ:
Анализ лекарственных средств, влияющих на функцию щитовидной железы
3. Лекарственные средства применяемые для лечения гипотиреоза
...
Анализ лекарственных средств, влияющих на функцию щитовидной железы
5. Лекарственные средства применяемые для лечения гипертиреоза (тиреостатики)
...
Биофармацевтическая оценка мягких лекарственных форм
Дерматологические пленки
Лекарственные пленки в современной номенклатуре лекарств представлены в основном фабричными пленками. Совершенно очевидно, что в отдельных случаях использование пленок может иметь ряд преимуществ (стерильность и безболезненность нанесения...
Диагностика хронического гастрита
5.1 Лекарственные препараты для лечения гастрита
1. Препараты, снижающие секрецию соляной кислоты (блокаторы Н2-гистаминовых рецепторов, ингибиторы протонной помпы). К блокаторам гистаминовых рецепторов относятся препараты группы фамотидина...
Назальные лекарственные формы
7. Перспективные лекарственные формы для лечения ринитов
Направления симптоматического лечения больных с ринитом как проявлением ОРЗ. Ухудшение экологической обстановки...
Ожоговые травмы
Классификация ожогов
Существует множество классификаций ожогов, большая часть из них основана на клиническом течении и тактике врача при той или иной ожоговой травме...
Преимущества флюорографии
4. Производство флюорограмм, маркировка и проявление плёнки
При работе крупнокадрового флюорографа (70 Ч 70 мм, 100 Ч 100 мм) по профилактическому обследованию органов грудной клетки производится 1 кадр на умеренном вдохе...
Расчет ультразвукового аппарата для стоматологии
6.3 Нанесение защитной пленки
Защитную пленку можно наносить несколькими способами. Из них наиболее распространены фотоспособ, офсетный способ и шелкография. При фотоспособе пленка светочувствительной эмульсии, нанесенная на фольгу...
Сестринский процесс при ожогах и обморожениях
2.1.1 Классификация ожогов
Существует множество классификаций ожогов, большая часть из них основана на клиническом течении и тактике врача при той или иной ожоговой травме...
Сестринский процесс при ожогах и обморожениях
2.2.1 Этиология ожогов
К ожогам приводят:(см. факторы поражения, в классификации ожогов по типу повреждения)...
Сестринский процесс при ожогах и обморожениях
2.3.1 Патогенез ожогов
Состоит в следующих патологических изменениях. Термическое поражение разрушает клетки или вызывает нарушение их функции. Степень ожога зависит от температуры и продолжительности воздействия термического агента...
Сестринский процесс при ожогах и обморожениях
2.6.2. Профилактика ожогов
Важно соблюдать правила пребывания на солнце (не находиться на солнце с 12 до 17 часов, использовать головной убор и солнцезащитный крем) и стараться не допускать перегрева, особенно у детей и пожилых людей...
Современные упаковочные материалы и упаковки для мазей
Пленки для фармацевтической промышленности
Пленки для фармацевтической промышленности Pentapharm® Мы, сотрудники КП знаем, что ваши клиенты нуждаются в безопасной высококачественной упаковке лекарственных препаратов...
Технология получения лекарственных пленок для лечения термических ожогов
1.1 Способы лечения термических ожогов
В разработке проблемы лечения ожогов достигнуты значительные успехи. Научно-исследовательская работа ведётся по различным направлениям - терапии ожогового шока, борьбе с ожоговым истощением и т .д...
Фармакотерапия глазных болезней
Глава 2. Новые лекарственные средства для лечения бактериальных и хламидийных конъюнктивитов
Последние годы ознаменовались внедрением в офтальмологическую практику целого ряда средств эффективной антибактериальной терапии системного и местного применения...
med.bobrodobro.ru
Состав основы для лекарственных пленок
Изобретение относится к области фармацевтической технологии. Состав основы для лекарственных пленок, применяемых для аппликации, содержит желатин, глицерин и воду при следущем соотношении компонентов, мас.%: желатин - 28,57, глицерин - 5,00, вода - 66,43. Использование предлагаемой основы позволяет получать пленки с хорошими биофармацевтическими и физическими свойствами.
Изобретение относится к области фармацевтической технологии, а именно к технологии изготовления лекарственных пленок, предназначенных для аппликации на слизистые оболочки.
Известны основы для подобных пленок, состоящие из коллагена (ВФС 42-724-78) - пленки "Облекол" (ФС-42-2538-88), из полимера биорастворимого (ФС-42-2715-90) - пленки с тиромеберином (ВФС-42-2313-94). Коллаген как основа для пленок наряду с достоинствами имеет и существенные недостатки: в связи с нерастворимостью его в воде процесс приготовления пленок связан с технологическими трудностями. Кроме того, коллаген, получаемый из животного сырья, сохраняет следы видовой специфичности и вызывает слабый иммунный ответ. Коллективом авторов предлагается основа следующего состава, мас.%: Желатин - 28,57 Глицерин - 5,00 Вода - 66,43 Желатин как продукт более глубокого гидролиза по сравнению с коллагеном лишен видовой специфичности. Желатин растворяется в воде и застывает при комнатной температуре, что делает технологический процесс простым и легко выполнимым. Кроме того, желатин полностью усваивается человеческим организмом, обладает гемостатическим действием и способностью стимулировать репаративные процессы. Желатин является прекрасным пленкообразователем. Биологическая доступность лекарственных веществ, введенных в гидрофильные желатиновые пленки, достаточно высока. От синтетических полимеров желатин выгодно отличается натуральностью, доступностью, дешевизной. Указанная концентрация желатина обеспечивает достаточную массу пленок и их дюрантное действие. Глицерин в составе данной основы служит влагорегулятором - он препятствует деформации пленок в процессе сушки, особенно ускоренной. Без глицерина края пленок высыхают быстрее, чем середина, что приводит к выпячиванию краев и западанию середины, а также к изгибанию пленок в вертикальной плоскости. Концентрация глицерина в данной основе оптимальна с точки зрения его роли как влагорегулятора. Таким образом, использование предлагаемой основы упрощает технологический процесс и позволяет получать пленки с хорошими биофармацевтическими и физическими свойствами.Формула изобретения
Состав основы для лекарственных пленок, применяемых для аппликации на слизистые оболочки, содержащий желатин, глицерин и воду при следующем соотношении ингредиентов, мас.%: Желатин - 28,57 Глицерин - 5,00 Вода - 66,43www.findpatent.ru
Технология получения лекарственных пленок для лечения термических ожогов
Влияние пленкообразователя на влагопоглощение лекарственной пленки
Определение влагопоглощения фитопленок проводили по методике описанной в подразделе 2.2.1. Эксперименту подвергали пленки на основе Na- КМЦ и желатина.
Результаты исследования влагопоглощения статистически обработаны и представлены в таблице 3.
Таблица 3
Результаты набухания фитопленок различных моделей
Из таблицы видно, что за весь период наблюдения ФП модели 2 не растворилась и обладает меньшей влагопоглощающей способностью по сравнению с ФП модели 1. У ФП на основе Na- КМЦ количество поглощенной воды выше, чем у ФП модели 2 и растворение ее наступило через 80 мин. после начала эксперимента.
Таким образом, из проведенного эксперимента можно сделать вывод: в связи с тем, что ФП модели 2 не растворилась в течение всего времени, желатин не может использоваться как основа для биорастворимой ФП. Следовательно, оптимальным вариантом для создания биорастворимой ФП пролонгированного действия может быть пленка модели 1.
На основании табличных данных была построена диаграмма, представленная на рис. 2, характеризующая антимикробную активность, адгезивные и влагопоглощающие свойства экспериментальных образцов ФП.
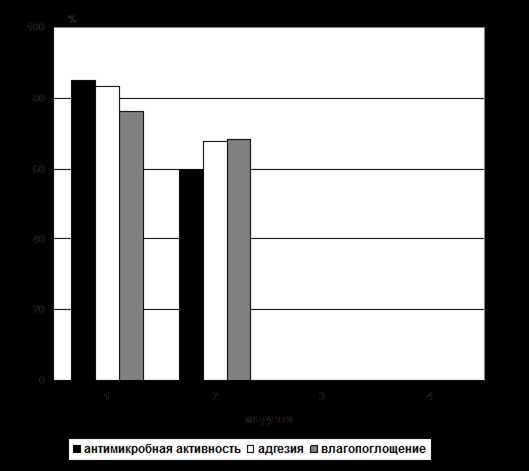
Рисунок 2 – Диаграмма свойств моделей фитопленок
Таким образом, исследования по выбору модели показали, что состав ФП модели 1 обладает наилучшими антибактериальными, адгезивными и влагопоглощающими свойствами. Модель 2 обладает низкими антибактериальными, адгезивными и влагопоглощающими свойствами, поэтому в качестве рационального и оптимального состава мы выбрали модель 4.
Таким образом, разработан состав лекарственной ФП для лечения термических ожогов с условным названием «Фитоплен».
Состав лекарственного препарата
«Фитодермопласт»
Состав на 1 пленку (г):
Настойка эхинацеи 0,468
Сок подорожника 0,468
Полифитовое масло 0,468
Na- КМЦ 1,0
Глицерин 1,14
Вода очищенная 17,14
3.2 Разработка технологии лекарственной фитопленки
На основе лабораторной технологии приготовления фитопленок, которая удовлетворяет всем требованиям, можно порекомендовать вынести лабораторное производство на промышленные масштабы и изготавливать фитопленку по схеме указанной на рисунке 3.
Технология процесса производства пленочной лекарственной формы
Технология производства пленочной лекарственной формы включает в себя следующие этапы:
ВР 1 Подготовка сырья
Отвешивание пленкообразователя, пластификатора и спиртовых извлечений проводят на весах.
ТП 1 Приготовление поливочного раствора
ТП 1.1 Приготовление раствора полимера. Осуществляется следующим образом: исходные компоненты (пленкообразователь, вода) отвешивают на весах, полимер обрабатывают водой, нагретой до 80-900 С, взятой в количестве 0,2-0,5 ч. от требуемого для получения раствора количества. При этом полимер смачивается и набухает, увеличиваясь в объеме в 40 раз.
ТП 1.2 Введение в раствор полимера пластификатора и фитокомплекса. В качестве пластификатора вводят глицерин, настойки зверобоя, прополиса и календулы смешивают друг с другом и вводят в раствор полимера.
ТП 1.3 Гомогенизация поливочного раствора проводят на смесителе с якорной мешалкой после снижения температуры массы до комнатной. Смесь тщательно перемешивают до получения однородного раствора.
ТП 1.4 Фильтрование поливочного раствора. Полученный поливочный раствор фильтруют через слой бязи.
ТП 1.5 Деаэрация поливочного раствора. Центрифугирование раствора в течение 2 часов для удаления пузырьков воздуха.
ТП 2 Приготовление пленок
ТП 2.1 Полив полимерной матрицы на подложки. Полученный раствор с помощью специальной установки наносят в два слоя (через щель) на поверхность металлической ленты, обработанную этиловым спиртом и движущейся со скоростью 0,13-0,14м/мин.
ТП 2.2 Сушка пленок. Полученную пленку сушат в камере с пятью зонами сушки от 40 до 480 С, охлаждают до 380 С и снимают пленку с металлической ленты в виде рулона диаметром 30см.
ТП 2.3 Снятие пленок с подложки и дозирование. Полученную пленку разрезают на полоски и с помощью штампа получают лекарственную пленку требуемого размера.
ТП 2.4 - Стерилизация. Стерилизацию осуществляют облучением при дозе 20 кГр или обработкой смесью этиленоксида с углеродом диоксида. Стерильность сохраняется в течение года.
УМО 1. Контроль качества и оформление готовой продукции
УМО 1.1 Контроль качества пленок. Оценка качества пленок проводится по физико-химическим свойствам: шероховатость поверхности, наличие трещин, разрывов, эластичность, прочность, адгезия, влагопоглощение и антимикробная активность.
УМО 1.2 Фасовка доз в пеналы дозаторы Готовые ЛП упаковывают по 30 штук в специальные пеналы-дозаторы, обеспечивающие герметичность и условия асептики при хранении и использовании. Применяют также контурно-ячейковую упаковку в алюминиевую фольгу или полихлорвиниловую пленку по 10 ЛП, которую укладывают в картонные коробки по 20-100 штук.
УМО 4.3 Упаковка и маркировка. Пеналы-дозаторы упаковывают в картонные коробочки с текстом маркировки.
Рисунок 3 – Схема технологического производства фитопленки для лечения термических ожогов
Заключение
В настоящее время ТТС нашли широкое признание из-за простоты употребления и высокой эффективности. Они используется для оказания как местного, так и резорбтивного воздействия в различных отраслях медицины.
Новым этапом в лечении термических ожогов является использование лекарственных фитопленок на основе биорастворимых полимеров медицинского назначения с включенными в них субстанциями природного происхождения, которые позволяют ускорить процесс заживления и препятствовать воспалительным процессам в местах ожога.
Для лечения термических ожогов наибольший терапевтический эффект наблюдается при местном применении лекарственного препарата, но применяемые в настоящее время различные растворы, мази, пасты, гели и т.д., недостаточно эффективны , поэтому разработка состава и технологии фитопленок для лечения термических ожогов является актуальной проблемой.
В пользу использования для лечения термических ожогов аппликационных лекарственных форм свидетельствуют многочисленные публикации о результатах апплицирования новых и стандартно используемых лекарственных пленок в лечении термических ожогов.
Анализ литературы свидетельствует в пользу использования тактики местного лечения термических ожогов лекарственными средствами с пролонгированным воздействием лекарственных веществ на патологический очаг, поэтому мы решили разработать рациональный состав и технологию лекарственных пленок с фитокомплексом.
В результате исследований выбран оптимальный состав фитопленки для лечения термических ожогов и проведена следующая работа: изучено влияние пленкообразователя - на качество фитопленки, антимикробную активность, адгезию и влагопоглощение. Кроме того, была установлена оптимальная степень влажности ФП, обеспечивающая ее наибольшую адгезивную способность На основании полученных данных можно сделать следующие выводы.
Выводы:
1.Разработан состав фитопленки на основе натрий-карбоксиметилцеллюлозы, которая представляет собой прочную, эластичную, однородную, без разрывов пленку светло-желтого цвета, со специфическим запахом, кислую на вкус, площадью 49 см2 и толщиной 0,038см.
.2. В результате микробиологических исследований методом диска установлено, что данная фитопленка обладает хорошей антимикробной активностью и может быть использована для лечения термических ожогов.
3. Изучены адгезионные свойства, наибольшей силой сцепления обладает пленка на основе натрий-карбоксиметилцеллюлозы со сепенью влажности 32,4%.
4. Полученная фитопленка обладает хорошей влагопоглощающей способностью и растворяется в течение 80 минут.
5. Разработана технология приготовления пленок, с условным названием «Фитоплен».
Список использованных источников
1. П.Г. Мизина, В.А. Куркин, Л.В. Куравель, В.А. Быков. Взаимосвязь структуры поверхности фитопленок и их адгезивных свойств // Фармация.-2001.-№6.- С. 26 – 27.
2. Б.А. Жубанов, Е.О. Батырбеков, Р.М. Искаков. Полимерные материалы с лечебным действием.-Алматы: «Комплекс», 2000.-220С.
3. С.Ф. Горячев. Безопасность жизнедеятельности и медицина катастроф.- Ростов н/Д.: «Феникс», 2006.-576С.
4. Ю.А. Синявский, М.К. Кошимбеков, И.Г. Цой, А.Я. Бекмуратов. Применение бальзама «Возрождение» при лечении ожоговых ран // Фармация Казахстана.- 2005.-№2.-С. 17-19.
5. М.И. Штильман. Полимеры медико-биологического назначения.- Москва: ИКЦ «Академ-книга», 2006.- 400С.
6. Н.А. Абсадыков, А.З. Карибжанова, С.К.Амзеева. «Фортум» в комплексном лечении ожоговой болезни // Фармация Казахстана.-2007.-№4.-С. 24-256.
7. С.А. Джумабеков, К.С. Сарбанова, Р.Х. Фозилов. Актовегин гель в терапии обширных ожоговых ран // Фармация Казахстана.-2005.-№9.- С. 33-35.
8. П.Г. Мизина. Фитопленки в фармации и медицине // Фармация -2000.-№5.-6.-С.38-40.
9. Т.Н. Юданова, И.В. Решетов. Современные раневые покрытия : получение и свойства (обзор) // Хим.-фармац. Журн.-2006.-№2.-С.24-30.
10. Т.Н. Юданова, И.В.Решетов. Современные раневые покрытия с иммобилизованными протеолитическими ферментами (обзор) // Хим.-фармац. Журн.-2006.-№8.-С.24-28.
11. Алексеева И.В. Разработка лекарственных форм для лечения ран. «Фармация», 2003.- С.43-45.
12. П.Г. Мизина, В.А. Куркин, В.А. Быков, О.И. Авдеева. Влияние вспомогательных веществ на влагопоглощение и адгезию фитопленок // Фармация.-2000.-№2.-С.12-14.
13. К.У. Ушбаев, С.А. Абдрахманов, Л.Е. Токешова. Лекарственные и пищевые растения Казахстана в терапии некоторых заболеваний.- Алматы .-2005.- 158С.
14. П.А Къосев. Полный справочник лекарственных растений.- Москва: «Эксмо», 2002.- 992 С.
15. А.И. Тенцова, М.Т. Алюшина. Полимеры в фармации.- Москва: «Медицина», 1985.-256 С.
mirznanii.com
|
apteka.uz











