Квазижидкое состояние воды на границе лед – диоксид кремния введение. Квазижидкая пленка воды на поверхности льда
От глории — к талой воде, или Отчего лёд скользкий
Что общего между радужными кольцами на облаках и особо скользким, слегка подтаявшим льдом? И то и другое — проявление удивительных свойств воды. Как ни странно, это обыденное вещество ещё слабо изучено. Вода способна иметь несколько модификаций, различающихся структурой и свойствами, то есть обладает полиморфизмом. С ним связано не только явление глории, о котором уже рассказывалось в «Науке и жизни», но и загадочные свойства тающего льда.Фото Натальи Домриной.
Упрощённая диаграмма вода–лёд разных модификаций (I—VI, всего же их имеется 12). Широко распространённый и знакомый всем лёд I существует при давлениях менее 2000 атмосфер и температурах ниже 0°С.
Глория — радужные кольца, возникающие при рассеянии света на холодных облаках.
Типичная проба частиц смешанного облака. Взята с самолёта в 1951 году. Вплоть до последнего времени столь «мирное» сосуществование жидких водяных капель с ледяными кристаллами в одном облаке считалось противоестественным.
Примесь А-воды хорошо заметна в талой воде.
‹
›
До недавнего времени считалось, что только твёрдое состояние Н2О (лёд) обладает разнообразием полиморфных форм. В лабораторных условиях удалось воспроизвести около дюжины различных кристаллических льдов с плотностью от 0,94 до более 1,6 г•см–3. Правда, в нормальных условиях выживает лишь самый лёгкий из них, хорошо знакомый нам лёд I.
То, что вода способна к полиморфии и в жидкой форме, впервые продемонстрировал ещё в 1960-х годах коллектив исследователей во главе с Б. В. Дерягиным. Они получили в лаборатории полиморфную форму Н2О, названную водой II. Она обладала плотностью около 1,4 г•см–3 и сохраняла жидкое состояние по крайней мере до –90°С даже в прямом контакте со льдом I (Дерягин Б. В., Чураев Н. В. Новые свойства жидкостей. — М.: Наука, 1971). К сожалению, это открытие оказалось забытым.
Не менее удивительная жидкая полиморфная форма воды существует в природных облаках с отрицательными температурами, или холодных облаках. Поначалу её обнаружили с помощью аппаратуры, установленной на самолёте-метеолаборатории. Подтвердить её существование и изучить физические свойства помогло загадочное природное явление глории (см. «Наука и жизнь» № 1, 2010 г.). То, что радужное кольцо глории служит практически неизменным спутником тени самолёта на заведомо холодных облаках, свидетельствует о значительном присутствии в них сферических частиц с показателем преломления 1,81—1,82. А поскольку всякое облако — продукт конденсации водяного пара, то, как показывает анализ, такими частицами могут быть только жидкие капли, состоящие из вещества Н2О с плотностью около 2,1 г•см–3. Эта полиморфная форма названа нами А-водой. Для сравнения напомним, что у обычной воды, в том числе переохлаждённой ниже 0°С, плотность близка к 1 г•см–3 и показатель преломления к 1,33.
Но не только названные качества отличают А-воду от переохлаждённой обычной воды, капли которой необратимо испаряются в присутствии ледяных частиц, жадно «поглощающих» выделившийся пар. Нами доказано, что только капли А-воды выполняют функцию жидкой фазы в облаках, где совершенно устойчиво сосуществуют с ледяными частицами. Вывод из этого конденсационного равновесия фаз: тончайшая «квазижидкая» плёнка, покрывающая, как обнаружено ещё в 1960-х годах, поверхность ледяных частиц, состоит из А-воды.
Кстати, все упомянутые свойства А-воды и льда вполне объяснимы с современных позиций физической химии. Обычный кристаллический лёд I и обычная жидкая вода с плотностью 1 г•см−3 (вода I) обладают внутренней структурой, образованной так называемыми водородными связями. Упрощённо говоря, межмолекулярная водородная связь образуется путём обобществления атомом водорода двух электронов, принадлежащих разным атомам кислорода. Уникальная геометрия связей каждой молекулы и позволяет веществу Н2О воплощаться в различные структуры. Структура кристаллического льда организована всеми четырьмя связями каждой молекулы и имеет вид жёсткой объемной тетраэдрической решётки. В обычной же жидкой воде подобная система связей страдает пространственно-временной незавершённостью и каждая молекула может участвовать в любой из возможных — от нуля до четырёх — постоянно возникающих и исчезающих мгновенных связей. Отсюда происходит её свойство текучести.
Замечательно, что плотность воды I превосходит плотность льда I. Эта уникальная особенность воды обусловлена тем, что расстояние между водородосвязанной парой молекул превышает масштаб колебательных связей. Отсюда вытекает закономерность, очень важная для понимания ряда аномальных свойств воды I: её плотность находится в обратной зависимости от удельной концентрации водородных связей. Согласно оценке, при полном отсутствии водородных связей плотность воды должна достигать максимального значения порядка 2 г•см–3 (Зацепина Г. Н. Структура и свойства воды. — М.: МГУ, 1998). И это, кстати, не единственное доказательство того, что А-вода с подобной же плотностью имеет неводородосвязанную, то есть аморфную, структуру.
Аморфной структурой обладает также «квазижидкая» плёнка на поверхности льда. Её физическая роль заключается в нейтрализации эффекта неустойчивости, вызванной обрывом водородных связей на границе ледяной структуры. Кроме того, эта плёнка служит оптимальной переходной средой для перестройки структуры при массообмене льда с окружающими фазами воды, в частности с водяным паром.
Справедливости ради отметим, что сообщения о реальном или предполагаемом существовании некоей жидкой «смазки» на ледяной поверхности приходят регулярно и с разных сторон. Мы просто пролили новый свет на физическую природу этой плёнки, неотъемлемо связанной со льдом и делающей его поверхность столь скользкой в любых обстоятельствах (что не всегда желательно). В этом отношении лёд даже служит своего рода эталоном в нашем сознании («скользкий как лёд» — говорим мы при случае). С повышением температуры выше точки плавления льда толщина переходного слоя А-воды увеличивается и лёд при этом становится более скользким.
Возникает вопрос: нельзя ли воспроизвести А-воду в лабораторных условиях и исследовать её теми же методами, что и обыкновенную жидкость? К сожалению, сегодня это не представляется возможным. Пока исследователям удавалось получить только незначительные количества твёрдой аморфной (по объективным данным) воды путем конденсации водяного пара на подложке при температуре около –173°С. С повышением температуры конденсат становится всё более вязким и одновременно склонным к спонтанному превращению в лёд I. В косвенных попытках измерений его плотности, по изменению объёма при кристаллизации, не учитывалось частичное испарение образовавшегося льда под воздействием энергии фазового перехода, а также обратной конденсации части выделившегося пара на лёд. Поэтому полученные неоднозначные результаты не вызывают доверия, за исключением того, что плотность твёрдой аморфной воды в целом заметно превосходит плотность льда I.
Более достоверными измерениями — по объёму и массе конденсата — его плотность определена как 2,3 г•см–3 при –173°С (Delsemme A. H., Wenger A. Superdense water ice. Science, 1970, 167, No. 3914, 44—45). С учётом термического расширения этот результат согласуется с полученным нами для А-воды (2,1 г•см–3 при –30°С).
При –120°С аморфный конденсат приобретает свойство текучести, то есть переходит в жидкое состояние, одновременно окончательно теряя устойчивость к переходу в лёд I. Это обстоятельство даже породило серьёзные сомнения в жизнеспособности жидкой формы конденсата. Наши исследования рассеяли эти сомнения. Устойчивым существованием жидкая А-вода в виде взвешенных в воздухе облачных капель, очевидно, обязана отсутствию в них центров кристаллизации. По этой причине «природная лаборатория» в виде холодных облаков предоставила уникально благоприятные возможности для изучения физических свойств аморфной воды.
Кстати, воочию наблюдать А-воду в природе вполне возможно. Бывает, что в по-настоящему морозный зимний день с неба вдруг низвергается дождь, и всё: дорога, снежные сугробы, одежда — покрывается ледяной коркой. Метеорологи называют это явление гололёдом, но не имеют его правдоподобного объяснения и, конечно, не подозревают, что этот дождь есть не что иное, как выпадение из облака сильно выросших капель А-воды.
А может ли А-вода, подобно обычной воде, устойчиво существовать при положительной температуре, где центры её кристаллизации попросту «не работают»? По всем соображениям в этом случае, в отличие от отрицательной температуры, конденсация обычной воды происходит при меньшей влажности, чем требуется для конденсации А-воды. То есть для образования или сохранения природных капель А-воды просто не хватает водяного пара в воздухе, поскольку его «перехватывает» обычная вода.
И всё же любой из нас сегодня имеет возможность увидеть А-воду собственными глазами в тёплой квартире и даже попробовать её на вкус. Для этого нужно совсем немного: домашний холодильник или мороз за окном, гладкостенный сосуд из прозрачного стекла (обыкновенный стакан), источник яркого света типа слайд-проектора, лупа. И, конечно, чистая вода — водопроводная, колодезная, бутилированная, кипячёная или дистиллированная. Поместим проектор непосредственно перед сосудом так, чтобы он создавал боковое по отношению к наблюдателю освещение содержимого сосуда. Воду для опыта следует выдержать до избавления от растворённого воздуха (он оседает в виде пузырьков на стенках сосуда) и проверить на отсутствие видимых примесей, после чего заморозить в форме кубиков.
Для начала нальём в сосуд немного воды, поместим в неё один-два кубика льда и проследим, как от подводной поверхности тающего льда отслаиваются обрывки эфемерной прозрачной плёнки, сразу же распадающиеся на более мелкие фрагменты. Это и есть частички А-воды. Они видны в обычной воде благодаря различию их показателей преломления, а сохраняются ввиду нерастворимости в обычной воде (новое свойство А-воды!), которая изолирует её от воздуха.
Для получения чисто талой воды загружаем в пустой сосуд кубики льда и позволяем им полностью растаять. Картина в сосуде после перемешивания воды выглядит подобно изображённой на фото.
Сразу предупредим, что размеры и количество взвешенных в воде частиц определяются толщиной переходной плёнки А-воды, которая в свою очередь зависит от степени минерализации воды. Минимальный эффект даёт дистиллированная вода. Возможно, придётся поэкспериментировать с выбором источника воды, чтобы добиться достаточно насыщенной картины для дальнейших наблюдений. Обратим внимание на то, что форма примесных частиц весьма далека от сферической. Это указывает на отсутствие поверхностного натяжения на границе раздела этих жидких фаз Н2О (ещё одно новое свойство А-воды!). Когда вода в сосуде успокоится, обнаруживается медленное коллективное нисходящее движение частиц, что подтверждает их повышенную плотность в сравнении с обычной водой. Со временем они опускаются на дно сосуда, однако первоначальная картина восстанавливается после перемешивания. В нашем опыте примесь А-воды в талой воде порой сохранялась неделями. Наконец, при внимательном наблюдении можно заметить, что отдельные наиболее крупные частицы опускаются быстрее других и сливаются с ними при столкновении. Так вести себя может только жидкость.
В заключение несколько отклонимся от темы. К числу неразгаданных чудес природы относятся не промерзающие до дна пресные водоёмы в вечной мерзлоте тундры, так называемые талики, а также обнаруженные в последнее время заполненные жидкой водой полости на различных глубинах пакового льда Антарктиды, иногда, по свидетельству очевидцев, даже выходящие на его морозную поверхность. Существует несколько гипотез о природе таких водоёмов. Одни исследователи считают, что вода в таликах по каким-то причинам имеет положительную температуру. По мнению других, она сильно минерализована и потому обладает пониженной температурой замерзания. Наконец, ответственность за особенно глубокое залегание таких водоёмов в Антарктиде возлагается на чудовищное давление льда. Подобные гипотезы, возможно, и применимы к каким-то частным условиям, но не содержат общего объяснения явления. Так или иначе, незыблемые физические установки заставляют всерьёз усомниться в возможности постоянного присутствия незамёрзшей обычной воды в контакте с кристаллическим льдом при отрицательных температурах. Но вспомним, что на это в принципе способна не признанная и забытая наукой вода II — «сверхплотная» вода Дерягина. А может быть, это и есть она, каким-то образом рождающаяся, пусть малыми дозами, и накопленная тысячелетиями в нерукотворном «морозильнике»? Во всяком случае, мы выдвигаем это предположение в качестве вполне серьёзной гипотезы. Очередь за её проверкой.
Детальное описание иллюстраций
Упрощённая диаграмма вода–лёд разных модификаций (I—VI, всего же их имеется 12). Широко распространённый и знакомый всем лёд I существует при давлениях менее 2000 атмосфер и температурах ниже 0°С. При более высоких давлениях появляются модификации льда, обозначенные римскими цифрами II, III, V, VI. В области существования льда V образуется лёд IV, который неустойчив и быстро переходит в лёд V. При давлениях более 40 000 атмосфер возникают лёд VII и, возможно, другие его модификации. Все они, как и лёд VI, не тают при температуре значительно выше 0°С. Плотность льда I на 10% ниже плотности воды — 0,92 г•см–3, а плотности льда II, III и IV равны соответственно 1,2; 1,1 и 1,38 г•см–3.
www.nkj.ru
Молекулярная теория сублимации » Сушка пищевых продуктов
Рассмотрение процесса на молекулярно-кинетическом уровне позволяет объяснить некоторые реально наблюдаемые явления. Согласно теории Я. И. Френкеля наибольшую вероятность сублимации имеют молекулы льда, которые обладают максимальной скоростью теплового движения и расположены на поверхности тела. В момент сублимации молекула затрачивает часть внутренней энергии на преодоление сил взаимодействия в твердом теле и сопротивления внешней среды. Таким образом, существует некоторый энергетический барьер, преодоление которого необходимо для сублимации молекулы из твердого тела. Очевидно, что наибольшую вероятность преодоления такого барьера имеют молекулы, возбужденные внешним источником энергии. Кроме того, возможны выход молекул воды на поверхность из глубинных слоев и их последующая сублимация на поверхности. Расположенная внутри кристалла молекула, возбужденная внешним источником энергии, срывается из положения равновесия, попадает в междоузлие кристаллической решетки и начинает диффундировать к поверхности. На месте дислоцированной молекулы возникает вакантное место («дырка»). Перемещаясь из одного положения в другое, такая молекула может попасть на поверхность материала и сублимировать. Наряду с возникновением пары дислоцированная молекула — дырка возможен и обратный процесс рекомбинации дырок и молекул. По-видимому, процесс «глубинной сублимации» наиболее вероятен при объемном поглощении материалом внешней энергии.
Молекулярная теория сублимации учитывает лишь среднее значение энергии отрыва молекул от поверхности, которое имеет смысл теплоты сублимации. В действительности расположенные на поверхности объекта молекулы могут находиться в различных условиях и характеризоваться отличающимися друг от друга значениями энергии отрыва. Кроме того, эта теория не объясняет наблюдаемое явление дискретной сублимации, т.е. одновременный отрыв и вылет в паровую среду целых микро- и макрогрупп молекул (ассоциатов). Это явление можно объяснить с позиций теории Фольмера-Странского, согласно которой поверхностные молекулы имеют различную энергетическую связь с твердым телом в зависимости от их расположения на микрорельефе. Молекула, находящаяся во впадине поверхностного микрорельефа, имеет большое число соседей и поэтому наиболее прочно связана с твердым телом. На остриях микрорельефа у молекулы меньшее число соседей, и она наименее прочно связана с твердым телом.При подводе внешней энергии расположенная во впадине молекула последовательно переходит в положения со все меньшим числом соседей, т.е. мигрирует к остриям и выпуклостям микрорельефа. Каждый такой переход уменьшает энергетические связи молекулы с твердым телом. В конце концов она занимает положение с наименьшим числом соседей и будет обладать минимальной энергией. При подводе внешней энергии эта молекула переходит в адсорбированное состояние, а затем уже — в окружающую газовую среду. С поверхности острия возможен и групповой отрыв молекул. Эта теория подтверждается исследованиями динамики возникновения и развития микрорельефа на поверхности сублимирующего льда при атмосферном давлении.
Предполагается, что поверхность сублимирующего льда является энергетически неоднородной. Неоднородность связана с дефектами кристаллической структуры льда. Сублимация уровне начинается в местах выхода на поверхность линий дислокации, т.е. одномерных дефектов кристаллической решетки. В этих местах энергетические связи молекул с кристаллической решеткой ослаблены и вероятность отрыва молекул наибольшая. В результате в зонах выхода дислокаций возникают микроуглубления. Поверхность льда в начальные моменты времени оказывается испещренной большим количеством мелких углублений чашеобразной формы. Сублимационные воронки характеризуются этот период малыми поперечными размерами и глубиной, формируя «сотовый» характер рельефа. В последующем происходят их углубление, расширение и частичное слияние, что приводит к формированию ориентированных углублений и каналов.
Очевидно, развитие вогнутых элементов рельефа имеет свой предел, после которого начинается сублимация выпуклых форм, характеризуемых в этот момент большей энергетической неустойчивостью. Появляются крупные по размерам и плавные по очертанию формы микрорельефа. На этой теперь уже полого-волнистой поверхности льда вновь прослеживается дальнейшее развитие мелких сублимационных воронок. По-видимому, в дальнейшем поверхность льда претерпевает подобный вышеописанному элементарный цикл развития форм микрорельефа, но уже на поверхности, унаследованной от предыдущего цикла. Однако такую форму процесса нельзя считать объемной, ибо ширина зоны микрорельефа несоизмеримо меньше определяющего геометрического размера объекта сушки (например, толщины слоя материала).
Наряду с дискретной сублимацией на молекулярном уровне возможны отрыв макрочастиц льда от поверхности сублимации и вылет их в разреженную среду. Это явление зарегистрировано П.А. Новиковым с помощью скоростной киносъемки, оно наблюдалось также Д.П. Лебедевым. Отрыву макрочастиц предшествовал обычно рост воронок льда на поверхности сублимации. По скорости вылета этих частиц определен градиент плотности парогазовой среды: на расстоянии 3 мм по нормали от поверхности тела плотность среды изменяется примерно на порядок. По А.В. Лыкову, из-за значительного увеличения объема вещества при сублимации (приблизительно в 106 раз) происходит явление, аналогичное взрыву с образованием квазиударной волны. Этим взрывом разрушается поверхностная структура, и твердые частицы уносятся потоком пара. Кроме того, наблюдается рост ворсинок льда на поверхности сублимации. А.В. Лыков считал, что это есть результат вытеснения переохлажденных жидких пленок воды из микротрещин и капилляров. По мнению Д.П. Лебедева, рост ворсинок обусловлен десублимацией выходящего пара на переохлажденной поверхности образца.
На гипотезе дискретного характера сублимации пара в разреженную среду основана и модель процесса, предложенная А.А. Гухманом. Согласно этой модели сублимация льда носит характер струйных течений, исходящих из дискретно расположенных очагов. Струи пара, вырываясь в разреженную среду, сильно ее турбулизируют, вызывая многократную циркуляцию парогазовой смеси между объектом сушки и нагревателями, этим явлением объяснено аномально высокое значение, коэффициента теплообмена в интервале давлений от 1330 до 13,3 Па (10—0,1 мм рт. ст.). Исследования В.А. Воскобойникова подтвердили адекватность «струйной модели» реальным условиям сублимации в вакууме и позволили уточнить количественные оценки эффекта турбулизации парогазовой смеси в сублимационной камере.
Предположение А.В. Лыкова о существовании на поверхности кристаллов льда жидкой пленки и ее миграции к поверхности сублимации подтверждается исследованиями в области гляциологии и геокриологии (мерзлотоведения). Считается установленным факт миграции жидких водных пленок в мерзлых породах даже при очень низких температурах. Движение таких пленок идет к зоне с наиболее низкими температурами (зоне промерзания). Этим явлением, например, объясняется повышение содержания солей в грунтах зоны промерзания по сравнению с областями с более высокой температурой, откуда начинается миграция влаги и где зарегистрировано снижение концентрации соли.
Существование и поведение жидких пленок на поверхности кристаллов льда и замороженных материалов объясняет принцип динамического равновесия воды, сформулированный Н.А. Цитовичем в 1945 г., согласно которому количество, состав и свойства жидкой фазы воды, содержащейся в мерзлых грунтах, не остаются постоянными, а изменяются с изменением параметров состояния данной системы, находясь в динамическом равновесии с последними. В последующие годы этот принцип оформился в сублимационно-термодинамическую теорию, которая получила практическое подтверждение в многочисленных экспериментальных исследованиях и находит все большее число сторонников. Суть данной молекулярной теории сублимации состоит в том, что в широком диапазоне отрицательных температур в мерзлых грунтах (и в других влажных материалах) на поверхности дисперсных частиц существует незамерзающая пленка влаги, связанная адсорбционными силами с твердым телом и образующая на его поверхности относительно подвижный квазижидкий слой. По Э.3. Кучукову, под сублимацией льда в дисперсных породах «можно понимать не только и не просто переход из твердого состояния в газообразное, минуя жидкое, но и процесс испарения незамерзающей воды при непрерывном пополнении ее запасов в грунте за счет подплавления льда». Доказано наличие в мерзлых породах жидкой фазы установлены основные закономерности, определяющие ее количество, определены свойства влаги поверхностного слоя, которые значительно отличаются от свойств свободной воды. Методами дилатометрии, калориметрии, диэлектрической спектроскопии, ядерно-магнитного резонанса доказано сосуществование в широком интервале отрицательных температур льда и подвижной фазы связанной воды. От степени дисперсности замороженного материала зависят существование и толщина квазижидкой пленки, а также скорость ее миграции. При атмосферной сублимации влаги из мелкодисперсных ионосодержащих пород (например, глины с диаметром пор менее 0,02 мкм) наблюдается увеличение градиента влажности, что объясняется именно миграцией незамороженной пленочной влаги. Такую форму сублимации уже можно отнести к объемной, поскольку влагосодержание уменьшается во всем объеме материала. В крупнодисперсных материалах с малым содержанием ионов (влагонасыщенные грубые пески с диаметром пор свыше 1000 мкм) практически вся влага кристаллизуется при понижении температуры до точки замерзания. Пленочной миграции влаги при атмосферной сублимации таких материалов нет, что подтверждается явно выраженной поверхностной формой фазового перехода и практически постоянной влажностью в замороженной зоне, которой не достиг фронт сублимации.
Существование жидкой пленки зависит не только от размера капилляров, но и от наличия адсорбционно-связанной воды в замороженном теле. Установлено, что переход влаги из твердой фазы в газообразную через жидкую пленку при отрицательных температурах характерен не только для области капиллярной конденсации, но и для моно- и полимолекулярной адсорбции. Скорость миграции такой жидкой пленки зависит от наличия в обезвоживаемом материале положительных ионов и от их валентности. С повышением валентности обменных катионов возрастает толщина пленки незамороженной воды. Н.А. Цитович, ссылаясь на опыты Ю. Юра и В. Харкинса, высказал гипотезу о существовании на поверхности сублимирующей твердой частицы двойного поверхностного слоя. Первая зона этого слоя названа граничной фазой. Она представляет собой раствор, содержащий адсорбированную воду.
Граничная фаза по отношению к слою ионов, образующих поверхность частицы, выполняет роль силового электрического поля. Энергия этого поля равна энергии разрыва водородных связей агрегатов воды. Если граничная фаза содержит какие-либо ионы, то ее действие как силового поля увеличивается. Граничная фаза совместно с поверхностным слоем ионов названа двойным поверхностным слоем. Она представляет собой наиболее активную, подвижную и постоянно изменяющуюся часть замороженной системы. Такая трактовка существования квазижидкой пленки получила развитие и в дальнейших исследованиях. Существованием квазижидкой пленки воды при отрицательных температурах можно, по-видимому, объяснить явление перехода влаги в дисперсных системах в стекловидное состояние (витрификация) при сверхбыстром охлаждении, ибо при температуре ниже температур основных фазовых переходов воды в лед оставшиеся молекулы незамерзшей воды оказываются настолько ориентированными, а вязкость этой части воды настолько возрастает, что ее молекулы уже не могут перестроиться, группироваться в структуру льда. Эта часть воды остается в стеклообразном состоянии.
С позиций сублимационно-термодинамической теории можно объяснить дискретный характер сублимации и развитие микрорельефа на поверхности фазового перехода. По-видимому, квазижидкая пленка, выходя на поверхность, частично сублимирует в газообразную среду и частично вымораживается. Этим объясняются дискретность процесса сублимации (по А.А. Гухману) и рост «ветвистых» кристаллов на поверхности раздела фаз (по А.В. Лыкову). На наш взгляд, процессы миграции молекул от микровпадин поверхности к остриям и последующий отрыв молекул от микровыпуклостей могут происходить одновременно с процессом миграции квазижидкой пленки к поверхности, ее сублимацией и вымораживанием. Таким образом, изложенные выше теории сублимации не противоречат, а дополняют друг друга; обе теории допускают устойчивость формы развитого микрорельефа при атмосферной и вакуумной сублимации.
Атмосферная сублимация мелкодисперсных горных пород хотя и имеет объемную форму, но этот процесс в природе протекает очень медленно. Например, по данным Э.3. Кучукова, при температуре сублимации —1,5°С и относительной влажности воздуха 60% толщина иссушенной путем сублимации незасоленной континентальной глины за 5 мес составляет всего 0,5—13,8 см, а за 30 лет — 5—118 см. Поэтому вряд ли имеет смысл специально учитывать этот малоинтенсивный процесс в искусственных условиях вакуумной сублимационной сушки, длительность которой редко превышает 10—20 ч. Однако такой эффект объемного обезвоживания, порождаемый миграцией квазижидкой пленки, по-видимому, должен активно проявляться при длительном холодильном хранении продуктов.
Материал подготовлен по книге: Камовников Б. П. и др. Вакуум-сублимационная сушка пищевых продуктов (Основы теории, расчет и оптимизация) /Б. П. Камовников, Л. С. Малков, В. А. Воскобойников. — М.: Агропромиздат, 1985 — 288 с.
www.prosushka.ru
ВЛИЯНИЕ ПЛЕНОК КВАЗИЖИДКОГО СЛОЯ НА ПОВЕРХНОСТИ ЛЬДА НА ТЕПЛОФИЗИЧЕСКИЕ СВОЙСТВА ДИСПЕРСНЫХ СРЕД НА ОСНОВЕ ГРАНУЛИРОВАННОГО ЛЬДА
КРИТИЧЕСКИЕ ПАРАМЕТРЫ ГАЗА
УДК 536.44 КРИТИЧЕСКИЕ ПАРАМЕТРЫ ГАЗА Е. Р. Лихачев Воронежский государственный университет Поступила в редакцию 01.03.2013 г. Аннотация: показано, что кроме критических параметров системы «жидкость-газ»
ПодробнееПримеры решения задач
26-27 уч. год. 2 8 кл. Физика. Тепловые явления. Примеры решения задач Задача 1. До какой температуры была нагрета при закалке стальная пилка массой 2 г если при опускании ее в сосуд с маслом через некоторое
ПодробнееМолекулярно-кинетическая теория
Оглавление 2 Молекулярно-кинетическая теория 2 21 Строение вещества Уравнение состояния 2 211 Пример количество атомов 2 212 Пример химический состав 2 213 Пример воздух в комнате 3 214 Пример воздушный
ПодробнееОсновные законы и формулы
2.3. ОСНОВЫ ТЕРМОДИНАМИКИ Основные законы и формулы Термодинамика исследует тепловые свойства газов, жидкостей и твёрдых тел. Физическая система в термодинамике (её обычно называют термодинамической) представляет
ПодробнееНасыщенные и ненасыщенные пары. Влажность.
Насыщенные и ненасыщенные пары. Влажность. Как отмечалось в первом задании, в жидкости (или твердом теле) при любой температуре существует некоторое количество «быстрых» молекул, кинетическая энергия которых
ПодробнееЛабораторная работа 6
Лабораторная работа 6 ИЗМЕРЕНИЕ КОЭФФИЦИЕНТА ТЕПЛОПРОВОДНОСТИ ГАЗОВ ПО СКОРОСТИ ОХЛАЖДЕНИЯ НАГРЕТОЙ НИТИ В состоянии равновесия температура T во всех точках системы одинакова. При отклонении температуры
ПодробнееЛАБОРАТОРНАЯ РАБОТА 5.4. Q=2prhq =-2p rhc dt dr. (1)
ЛАБОРАТОРНАЯ РАБОТА 5.4 ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА ТЕПЛОПРОВОДНОСТИ ВОЗДУХА Цель работы: экспериментальное определение коэффициента теплопроводности воздуха. Литература: [4] гл. 5 5.1, 5.2, 5.5; [7] гл.
ПодробнееТема 6 Термодинамическая система
Тема 6 Термодинамическая система 1. Параметры состояния. 2. Термодинамическое равновесие. 3. Внутренняя энергия. 4. Работа и теплообмен, как формы передачи энергии. 5. Равновесные и неравновесные процессы.
ПодробнееЛекция 4. Аэрозоли как ядра конденсации.
Лекция 4. Аэрозоли как ядра конденсации. Энергия образования сферической капли воды Пусть имеется термодинамическая система (ТДС), состоящая только из молекул водяного пара. Определим, какую энергию нужно
ПодробнееМКТ И ТЕРМОДИНАМИКА 2
ЗАДАЧИ 1 МКТ И ТЕРМОДИНАМИКА 2 Качественные задачи 1. Чему равно число степеней свободы двухатомной молекулы? 2. Можно ли утверждать, что броуновское движение есть тепловое движение молекул? 3. На высоте
ПодробнееОПРЕДЕЛЕНИЕ ТЕПЛОЕМКОСТИ ТВЕРДЫХ ТЕЛ
Лабораторная работа 6 ОПРЕДЕЛЕНИЕ ТЕПЛОЕМКОСТИ ТВЕРДЫХ ТЕЛ Цель работы определение теплоемкости образцов металлов калориметрическим методом с использованием электрического нагрева. Из теории идеального
ПодробнееИТОГОВЫЙ ТЕСТ ПО ФИЗИКЕ Вариант 7
А. А. Пинский, В. Г. Разумовский, Н. К. Гладышева и др. ИТОГОВЫЙ ТЕСТ ПО ФИЗИКЕ 8 класс Вариант 7 Ниже даны справочные материалы, которые могут понадобиться Вам при выполнении работы. УДЕЛЬНАЯ ТЕПЛОЕМКОСТЬ
ПодробнееПрактическое занятие мая 2017 г.
4 мая 2017 г. Теплопроводность это процесс распространения теплоты между соприкасающимися телами или частями одного тела с различной температурой. Для осуществления теплопроводности необходимы два условия:
Подробнее01;03;05. k t = b v2 z 2. k t = z z. c f v = z k t dz =
01;03;05 К теории образования слоистой структуры льда на поверхности пластины, помещенной в поток переохлажденного водного аэрозоля Р.Г. Закинян Ставропольский государственный университет, 355035 Ставрополь,
Подробнее8 класс «а», «с», «н» 1 триместр
Основные понятия: Тепловые явления Обязательный минимум по предмету физика 8 класс «а», «с», «н» 1 триместр Тепловое движение. Внутренняя энергия. Два способа изменения внутренней энергии: работа и теплопередача.
ПодробнееОткрытый банк заданий ЕГЭ
Воздушный шар объемом 2500 м 3 с массой оболочки 400 кг имеет внизу отверстие, через которое воздух в шаре нагревается горелкой. Какова максимальная масса груза, который может поднять шар, если воздух
ПодробнееТема 1.2. Теплопередача и её виды.
Тема 1.. Теплопередача и её виды. 1. Физическая сущность теплопередачи.. Теплопроводность. 3. Конвективная теплопередача. 4. Тепловое излучение. 1. Физическая сущность теплопередачи. Согласно молекулярной
ПодробнееИзучение работы p-n перехода
НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ НИЛ техники эксперимента МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ЛАБОРАТОРНОМУ ПРАКТИКУМУ ПО КУРСУ «ФИЗИКА» www.rib.ru e-mail: [email protected] 010804. Изучение работы -
ПодробнееИндивидуальное. задание N 7
Индивидуальное задание N 7 1.1. Два сосуда одинакового объема содержат кислород. В одном сосуде давление Р 1 =2 МПа и температура Т 1 =800 К, в другом Р 2 =2,5 МПа, Т 2 =200 К. Сосуды соединили трубкой
ПодробнееЭлектронный архив УГЛТУ
4. Управление качеством продукции: справочник / под. ред. В.В. Бойцова, А.В. Гличева. М.: Издательство стандартов, 1985. 464 с. 5. ГОСТ 4.208-79. Система показателей качества продукции. Строительство.
ПодробнееТЕМПЕРАТУРНАЯ ЗАВИСИМОСТЬ ЭЛЕКТРИЧЕСКОГО
Кафедра экспериментальной физики СПбГПУ ЛАБОРАТОРНАЯ РАБОТА 202 ТЕМПЕРАТУРНАЯ ЗАВИСИМОСТЬ ЭЛЕКТРИЧЕСКОГО СОПРОТИВЛЕНИЯ МЕТАЛЛА И ПОЛУПРОВОДНИКА ЦЕЛЬ РАБОТЫ Определение температурного коэффициента сопротивления
ПодробнееЛабораторная работа 9
КАЛМЫЦКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Кафедра общей физики Лабораторная работа 9 «Определение теплоты перехода воды в пар при температуре кипения» Лаборатория 211 Лабораторная работа 9 «Определение теплоты
ПодробнееИзмерение постоянной Больцмана
Ярославский государственный педагогический университет им. К. Д. Ушинского Кафедра общей физики Лаборатория молекулярной физики Лабораторная работа 2 Измерение постоянной Больцмана Ярославль 2007 Оглавление
Подробнееdocplayer.ru
Плавление начинается с поверхности • Игорь Иванов • Научно-популярные задачи на «Элементах» • Физика
Первым делом надо четко сказать, что наша модель, безусловно, очень упрощенная и даже искусственная. Она не учитывает ни реальный вид решетки, ни реальное взаимодействие молекул, ни квантовых эффектов, ни блуждание молекул сверху поверхности, ни то, как потеря кристаллического порядка проникает вглубь кристалла. Но она ничего этого и не должна была учитывать. Главная задача этой модели — преодолеть страх, который возникает у многих людей, интересующихся современной физикой, когда им предлагают перейти от словесных описаний к минимальным вычислениям. Обычно считается, что любой вопрос про современную физику будет обязательно очень сложным, и разобраться с ним «простому гражданину» нереально. Вовсе нет! — многие численные оценки по порядку величины можно делать самому. Согласитесь, у этой задачи короткое решение и понятный ответ; он моментально превращает общие словесные рассуждения в четко осязаемое число. Это решение не требует никаких сложных формул, не использует никакие сокровенные знания из физики, оно вполне по силам человеку, который внимательно прочтет вступление и подумает над предложенной моделью. Надо просто не бояться делать таких попыток.
Возвращаясь к физике, заметим, что полученный нами ответ может показаться слишком экстремальным. На основе повседневного опыта человек обычно готов допустить, что какое-то предплавление может происходить при температурах порядка –1°C или около того. Но уж в морозилке-то (–18°C) никакого плавления не должно быть, разве не так? Опасность упования на повседневный опыт состоит в том, что мы можем непосредственно пощупать только то, что происходит с приповерхностным слоем толщиной в десятки и сотни микрон. Но в задаче речь идет про одноатомный слой! И потому, когда квазижидким остается только этот слой, повседневный опыт нам ничем не поможет, мы предплавление просто не заметим, для этого нужны тонкие методы экспериментальной физики.
Поскольку изучение льда представляет огромную ценность (как чисто научную, так и прикладную), были проведены многочисленные исследования того, что же действительно происходит на поверхности льда при понижении температуры. Самые первые опыты, косвенно демонстрирующие наличие квазижидкого поверхностного слоя, ставил еще Майкл Фарадей в 1850-е годы. Правда, его интерпретация экспериментов встретила жесткие возражения коллег, поэтому в течение целого столетия этот вопрос оставался в тени. К нему физики всерьез вернулись только во второй половине XX века, и самыми разными методами доказали наличие этого слоя и изучили разнообразные его характеристики. Состояние этой науки на конец 1970-х годов отражено в прекрасной научно-популярной книжке японского физика Н. Маэно «Наука о льде», переведенной в 1988 году на русский язык.
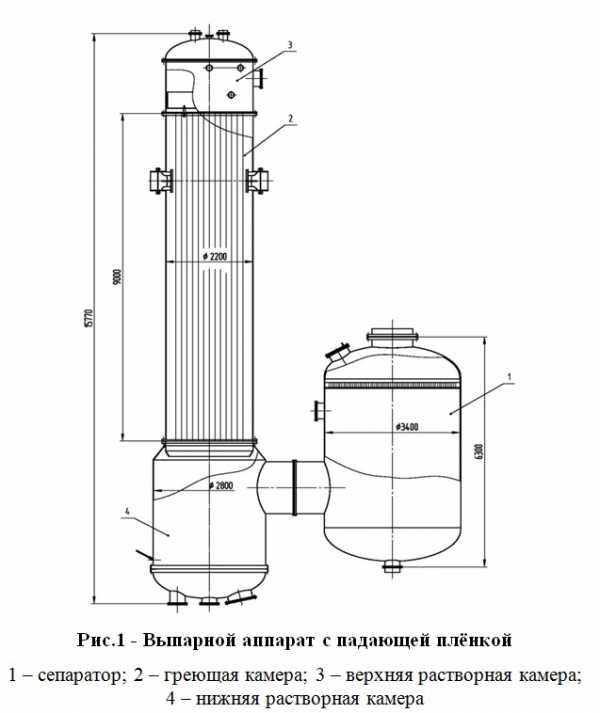
Правда, по мере накопления данных ситуация с экспериментальными результатами, казалось, только запутывается. Например, разные методики измерения толщины слоя в зависимости от температуры давали результаты, порой отличающиеся друг от друга на целый порядок (рис. 4). Но для нас важно одно: все эти эксперименты действительно видят тончайший водный слой вплоть до температур, сравнимых с той, что мы получили в рамках простейшей модели. Так что найденный ответ оказался не так уж и далек от истины!
Что касается данных, то спустя какое-то время было понято, что все эксперименты проводились в разных условиях (вакуум или атмосфера, наличие водяных паров или сухой воздух), а кроме того, на толщину квазижидкого слоя сильно влияли даже небольшие примеси посторонних веществ, растворенных во льду. Поэтому корректного сравнения пока достичь не удается, но в будущем такое «воссоединение методик» нужно будет провести.
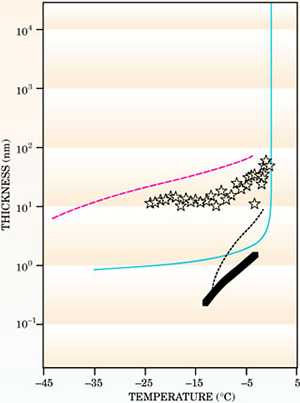
Если же обратить внимание именно на самый-самый поверхностный слой молекул в кристалле льда, то здесь самые аккуратные данные были получены в 2001 году (статья в журнале Phys.Rev.Lett., новость на scientific.ru). С помощью спектроскопического и поляризационного анализа авторы смогли выделить сигнал от «торчащих наружу» OH-связей и измерили их ориентационную упорядоченность. Результаты (см. рис. 5) показали, что постепенная потеря упорядоченности начинается аж при –70°C! Кстати, результаты численного моделирования поведения микрокусочка льда методом молекулярной динамики тоже дают примерно такие числа.
Ну и напоследок скажем, что мы только по верхам коснулись одной лишь темы в этом большом разделе физики. Более подробно о структуре поверхности льда, а также о геофизических, климатических, астрофизических и повседневных последствиях этой структуры можно узнать из упомянутой уже книжки Н. Маэно «Наука о льде», а также англоязычных статей: R. Rosenberg. Why Is Ice Slippery? // Physics Today 56, 50 (2005) и J. G. Dash, A. W. Rempel, J. S. Wettlaufer. The physics of premelted ice and its geophysical consequences // Reviews of Modern Physics 78, 695–741 (2006).
elementy.ru
Квазижидкое состояние воды на границе лед – диоксид кремния введение
УДК 81+31.15.00+29.19.00+539.2
Ю.В. Земцова, Л.В. Фомина
Квазижидкое состояние воды на границе лед – диоксид кремния
Введение
Свойства кристаллических и аморфных водных льдов вызывают устойчивый интерес, что обусловлено рядом причин. Вода играет важнейшую роль в биологических процессах, и знание образуемых молекулами воды характерных структур может помочь в определении структур связанной воды в системах с белками и другими биологическими молекулами. Во-вторых, вода – одно из наиболее распространенных веществ во Вселенной, и изучение состояний, в которых она в принципе может находиться на других небесных телах или в межзвездном пространстве, представляет несомненный интерес. В-третьих, исследование воды имеет общетеоретическое значение, так как позволяет понять основные особенности строения и многообразия кристаллических форм многих других веществ с тетраэдрической координацией молекул (атомов), а также причины многообразия аморфных форм одного и того же вещества и закономерности фазовых переходов между ними, природу аморфизации кристаллов под давлением, природу твердотельной кристаллизации из аморфного состояния и многие другие вопросы общего характера.
Для некоторых водных льдов имеются близкие структурные аналоги среди других кристаллических веществ (рис. 1), построенных из тетраэдрически координированных атомов. Так, лонсдейлит (гексагональная модификация алмаза), вюрцит (ZnS) и высокотемпературный тридимит (SiO2) изоструктурны льду Ih; алмаз, высокотемпературный кристобалит (SiO2) и сфалерит (ZnS) изоструктурны льду Ic. Отметим, что в каркасах вюрцита и сфалерита атомы Zn и S чередуются в позициях, занимаемых в соответствующих им льдах Ih и Ic атомами кислорода, а в модификациях SiO2, изоструктурных кристаллическим льдам, вместо каркасов из атомов кислорода, связанных водородными связями, присутствуют подобные каркасы из атомов кремния, соединенных ковалентными связями [1, с. 64–84].
Среди перечисленных выше изоструктурных соединений наиболее интересным в данном случае является диоксид кремния, это связано с его распространением в природе. Свободная двуокись кремния (иначе – кремнезем, кремневый ангидрид) встречается преимущественно в виде минерала кварца, который составляет основу обычного песка. Последний является одним из главных продуктов разрушения горных пород и одновременно одним из важнейших строительных материалов, мировое потребление которого составляет около 500 млн т ежегодно. На долю свободной двуокиси кремния приходится приблизительно 12% от массы земной коры. Гораздо большее количество SiO2 (около 43% от массы земной коры) химически связано в составе различных горных пород. Следовательно, земная кора более чем наполовину состоит из двуокиси кремния [2].
Наибольший интерес вызывают процессы взаимодействия на границах раздела воды или водных льдов с различными структурами SiO2.
Например, особое состояние воды зафиксировано физиками из Института металлов имени Макса Планка в Штутгарте. Они обнаружили, что на поверхности соприкосновения льда с диоксидом кремния возникает тонкий квазижидкий слой воды, плотность которой на 17% больше, а температура замерзания примерно на 15 градусов ниже, чем у обычной воды. Толщина слоя всего около двух нанометров. Однако вода в этом слое может инициировать активное таяние льда [3].
1. Моделирование и описание метода расчета
Из водных льдов наиболее стабильна модификация Ih, т.е. лед гексагональной структуры. Из модификаций кремнеземов наиболее стабильным является кварц, но в метастабильном состоянии способны также существовать такие модификации SiO2, как тридимит, кристобалит и аморфный диоксид кремния.
Предложены супрамолекулярные модели наноструктурных интерфейсов между гексагональной модификацией льда и различными модификациями диоксида кремния – аморфной модификацией и кристаллическими модификациями – кварцем, тридимитом и кристобалитом.
Опишем физико-химические механизмы и закономерности для системы диоксид кремния – лед, которая имеет по всем трем направлениям нанометрический размер.
Расчет проводился в программе Hyper Chem ver 6.0 при помощи неэмпирических методов.
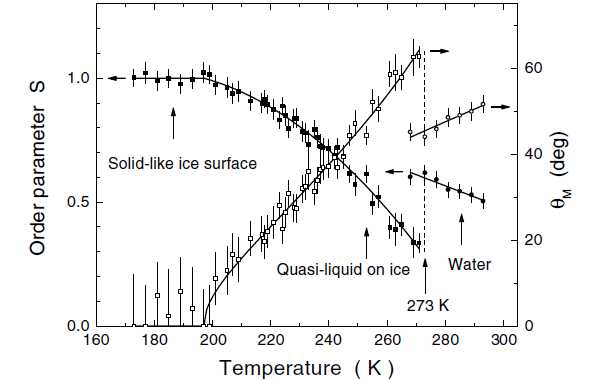
Неэмпирические расчеты основаны на точном решении уравнения
,
где
 – энергия отталкивания ядер;
– энергия отталкивания ядер;
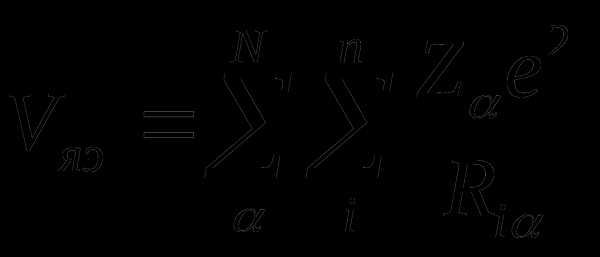 – энергия притяжения электронов к ядрам;
– энергия притяжения электронов к ядрам;
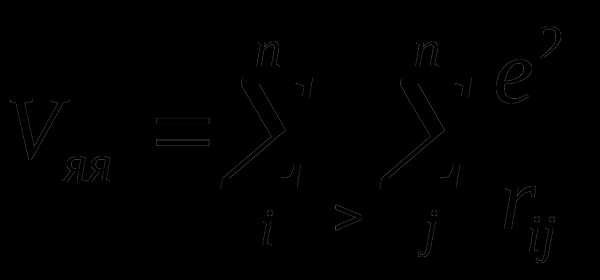 – энергия отталкивания электронов.
– энергия отталкивания электронов.
которые не включают никаких экспериментальных параметров, кроме фундаментальных физических постоянных. Затраты времени ЭВМ при выполнении неэмпирических расчетов даже с использованием минимального базиса АО значительно выше, чем для полуэмпирических методов, и быстро растут с увеличением размеров базиса АО. Благодаря быстрому прогрессу технических возможностей современных ЭВМ область приложений неэмпирических расчетов непрерывно расширяется. В современной теоретической химии неэмпирические расчеты молекул становятся постепенно общедоступными.
Одно из особенно важных достоинств неэмпирических схем расчета состоит в том, что легко установить их строгую иерархию, основанную на сопоставлении получаемых с их помощью значений полной энергии. Свойство вариационности неэмпирических методов дает возможность, улучшая постепенно форму искомой волновой функции, приближаться к результату, достигаемому вначале в хартри-фоковском пределе, а затем к результату, достигаемому точным решением уравнения Шрёдингера. Поскольку каждый шаг на этом пути сопряжен с быстрым нарастанием затрат машинного времени, исследователь останавливается на расчетной схеме той или иной степени сложности, обеспечивающей должный компромисс между желаемым уровнем точности решения и затратами машинного времени. Практика расчетов выработала определенные критерии для выбора подходящих при решении различных задач приближений неэмпирических расчетов.
Выбор базисных атомных функций в разложении ЛКАО является важной задачей, так как именно им определяется, насколько точно ряд ЛКАО аппроксимирует молекулярную орбиталь Хартри-Фока. Этот ряд должен достаточно быстро сходиться, т.е. малое число атомных орбиталей должно аппроксимировать МО с требуемой точностью. Существует три основных критерия для выбора базисных функций:
1. Базисные функции должны давать в основном хорошее приближение к истинной волновой функции (например, возле ядер и на больших расстояниях от них).
2. Базисные функции должны допускать аналитическое вычисление нужных интегралов.
3. Полное число базисных функций не должно быть очень большим.
Простейший уровень неэмпирических расчетов – использование минимального базиса АО. Наиболее распространенным способом сжатия базиса является схема STO-NG – т.е. минимальный базис орбиталей, в котором N гауссовских функций использованы для аппроксимации одной слетеровской. В большинстве случаев ограничиваются N = 3, т.е. используют минимальный базис STO-3G, что мы и делали, так как при дальнейшем увеличении точность результатов растет очень медленно [4, с. 203–206].
2. Компьютерный эксперимент и анализ полученных данных
Рассмотрим наноблок h30O10 со структурой льда Ih (кристаллическая фаза нормального давления, имеющая гексагональную структуру). По данным ab-initio расчетов внутримолекулярная водородная связь имеет длину 1,8 Å и энергию -36 кДж/моль.
Рассмотрим фрагмент нанослоевого интерфейса аморфной и кристаллических структур оксида кремния и льда Ih. Образование интерфейса на примере взаимодействия льда Ih и тридимита представлено на рисунке 2.
Моделируем интерфейс двух наноблоков Si10О20 и Н20O10, между которыми возникают водородные связи. Длина этих связей 2,6 Å, а энергия составляет -32 кДж/моль. То есть по энергии они близки к внутримолекулярным водородным связям.
Несмотря на то, что энергия молекулярной водородной связи одинакова во всех структурах, число этих связей в интерфейсе различно и, как следствие, отличаются энергии адгезии. Наибольшей адгезионной энергией (-130 кДж/моль) с Н20O10 обладает аморфный диоксид кремния, так как он образует пять молекулярных водородных связей. Следующее место по величине энергии адгезии (-104 кДж/моль) занимает тридимит, который образует четыре таких же связи. Это возможно благодаря тому, что он изоструктурен льду Ih. Кристаллические модификации оксида кремния кристобалит и кварц имеют лишь по три молекулярных водородных связи, что соответствует энергии адгезии -78 кДж/моль. Такое количество связей обусловлено структурой этих модификаций.
Заключение
Взаимодействие различных структур водных льдов с различными структурами диоксида кремния интересно, прежде всего, в общетеоретическом плане. Понимание процессов, протекающих на границе различных сред, позволит в будущем создавать материалы с прогнозируемыми, заранее заданными свойствами. Кроме того, исследования в этой области уже сейчас могут принести практическую пользу. Например, явление квазижидкого слоя воды имеет большое значение для понимания процессов движения ледников и обледенения крыльев самолетов, а также существенно для изучения образования нефти и зарождения жизни. Становится возможным изучение синтеза сложных органических веществ из воды, метана и водорода при экстремальных условиях в нанопорах оксида кремния, которые являются природными наноавтоклавами.
Библиографический список
Желиговская, Е.А. Кристаллические водные льды / Е.А. Желиговская, Г. Г. Маленков // Успехи химии. – 2006. – 75(1).
/nekrasov/x-03.html
/cgitaf/DynaPage.taf?file=/nature/journal/v428/n6982/abs/nature02449_fs.html
Минкин, В.И. Теория строения молекул. / В.И. Минкин, Б.Я. Симкин, Р.М. Миняев. – Ростов-на-Дону, 1997
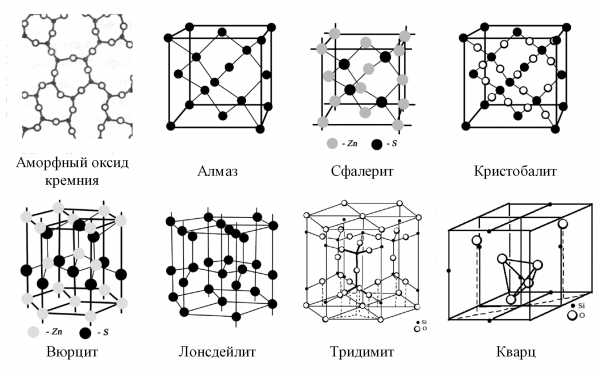
Рис. 1. Структурные аналоги льдов, среди других кристаллических веществ
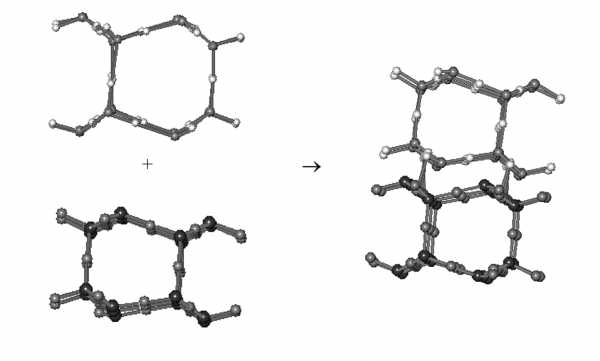
Рис. 2. Образование интерфейса между наноблоками льда Ih и тридимита
textarchive.ru
Адсорбция влаги на металлах (окислах) и свойства адсорбционных пленок влаги
из "Коррозия и защита от коррозии Том 3"
Первые классические работы Вернона [15] показали, что скорость коррозии металлов является функцией относительной влажности атмосферы. Из этого факта следовал вывод о наличии связи между скоростью коррозионных процессов и толщиной адсорбированных на поверхности металлов слоев влаги. Однако измерение толщины адсорбированных слоев воды на гладких поверхностях металлов с достаточной степенью точности до последнего времени встречало больщие методические трудности. [c.155] Эксперименты, проведенные Томашовым и сотр. [16] на гладких поверхностях металлической фольги, показали, что толщина адсорбционных слоев влаги на железе возрастает от 15 молекулярных слоев при влажности 55% До 92 молекулярных слоев при влажности около 100% (считая истинную поверхность железа в два раза больще геометрической поверхности). Для меди и цинка значения толщины адсорбционных пленок влаги немногим отличаются от полученных на железе. [c.155] К этому же периоду относятся адсорбционные исследования Лоу [17] и Кавасаки [18] на германии. Из этих работ следует, что по мере увеличения относительной влажности до 80% количество паров воды, адсорбированной на германии, возрастает до 3 молекулярных слоев. Последующий рост относительной влажности до 100% приводит к увеличению толщины адсорбционной пленки до 7 монослоев (рис. 1). Приблизительно эти же значения толщин наблюдала Бурщ-тейн в процессе адсорбции влаги на гладкой платине при комнатной температуре [19]. [c.155] Если далее учесть, что адсорбция влаги, как правило, изучается на металлах. Находящихся в чехле из окисла [20], можно ожидать известную идентичность в адсорбционной способности окисленной поверхности металла и объемных окислов. Так, на большинстве полупроводников и диэлектриков окисного типа количество адсорбированной воды в области относительной влажности ниже 100% не превышает 7—10 молекулярных слоев [21 . [c.156] Поверхностная концентрация гидроксильных групп (после взаимодействия окисла с водой) составляет 8—12 мкмоль1м для окислов цинка [31], титана [32] и алюминия [33], т. е. около 5—8 ОН-групп на 100 А . [c.157] Поверхностные гидроксильные группы столь. прочно связаны с окислом, что заметное дегидроксилирование возможно только при температурах, превыщающих 100—200°. Подобная устойчивость гидроксильных групп наблюдается на окислах цинка [34], алюминия [35], германия [36] и др. [c.157] Интересным свойством поверхностных гидроксильных групп на окислах (с точки зрения коррозии) является их способность обмениваться с галогенами [37]. [c.157] Киселев развивает представление о том, что адсорбция воды может протекать не только на гидроксильных группах поверхности окисла, но и на негидратированных центрах за счет образования координационных связей [21, 39]. [c.157] Исследованиями [40, 41] доказано, что при адсорбции воды на гидроксилированной поверхности окисла имеет место образование роев молекул. Для образца, содержащего количество воды, примерно равное монослою по БЭТ, адсорбированная фаза представляет собой островки толщиной в 2— 3 молекулы воды. Только при наличии 3 монослоев по БЭТ предполагается слияние островков, растущих в тангенциальном направлении. В этом смысле образование полимолекулярных слоев влаги аналогично механизму возникновения зародышей окисла при окислении чистых поверхностей металла в атмосфере кислорода [42, 43 . [c.157] Изучению свойств моно- и полимолекулярных пленок посвящено огромное количество исследований [44 . Мы ограничимся рассмотрением тех свойств, которые могут оказывать прямое влияние на коррозионные процессы. Одним из таких свойств является электропроводность адсорбированного слоя воды. [c.158] Известно, что поверхностная проводимость многих неорганических диэлектриков и полупроводников является функцией относительной влажности воздуха (или толщины адсорбированного слоя влаги [45]). Например, по данным Пе-ревертаева и Мецика [46], не только поверхностная проводимость (стп), но и удельная проводимость (оу) воды на свежеобразованном сколе слюды зависят от толщины адсорбированной пленки (рис. 3). [c.158] Имеется несколько объяснений увеличения поверхностной проводимости в присутствии пленки влаги а) адсорбированная вода диссоциирует [47] б) гидратируются адсорбированные на поверхности ионы [48] в) поверхность твердого тела гидролизуется [491 г) щелочные ионы диффундируют из поверхностного слоя адсорбента в пленку влаги (в случае стекла) [50] д) сильная протонизация координационносвязанных молекул воды, которая способствует интенсивному протонному обмену внутри роя при наличии водородных связей [21, 51] и др. Многие наблюдения подтверждают диссоциацию физически и химически сорбированной воды [52, 53]. [c.158] Изучение изменения поверхностной проводимости кварца от относительной влажности воздуха (толщины адсорбционного слоя) показало, что в области Р/Ро=0,2 0,3 (где согласно БЭТ формируется молекулярный слой) имеет место резкое изменение скорости нарастания поверхностной проводимости. Это указывает на то, что вода, сорбированная при Р/Ро=0,2 0,3 обладает отличными электрическими свойствами от воды, сорбированной при P/Pq 0,3. Чапек полагает, что при формировании мономолекулярного слоя (и последующих одного —двух) происходит диссоциация воды с образованием двойного электрического слоя. Диссоциация воды продолжается до тех пор, пока не будет завер-щено формирование двойного электрического слоя (в области 3—30 монослоев). [c.159] Эти данные Чапека подтверждают приведенные выще результаты Перевертаева, но объяснение наблюдаемых явлений находятся в явном противоречии с представлениями о механизме электропроводности молекулярных слоев с водородными связями [21, 51]. [c.159] Другим, не менее важным, с точки зрения атмосферной коррозии, свойством адсорбционных слоев воды является понижение температуры фазовых переходов. Было обнаружено [56], что в области моно- и полимолекулярной адсорбции не наблюдается замерзания адсорбированного вещества. Фазовый переход имел место только в капиллярно-конденсацион-ной области изотермы адсорбции. Это явление больщинство исследователей интерпретирует с позиций теории капиллярной конденсации, согласно которой понижение температуры затвердевания жидкости связывается с понижением упругости пара над менисками в капиллярах. [c.159] Киселев [57] высказал предположение, что явление понижения точки замерзания (или плавления) можно интепрети-ровать, исходя только из свойств вещества в адсорбированном состоянии, для которого условия кристаллизации и плавления будут иными, чем в объеме нормальной жидкости. В связи с этим следует отметить, некоторые особенности поверхности льда. На основании чисто электростатических расчетов Флетчер [58, 59] нащел зависимость толщины квази-жидкой пленки воды на поверхности льда от темпераТ-уры. [c.159] Так при температурах от—10° до —20° толщина пленки составляет десятки ангстрем. Экспериментальное подтверждение существования квазижидкой пленки воды на поверхности льда осуществлено методом ЯМР [60 . Понижение температуры фазового перехода воды в адсорбированном состоянии достигает 90—100°. [c.160]Вернуться к основной статье
chem21.info
Квазижидкое состояние воды на границе лед – диоксид кремния
УДК 81+31.15.00+29.19.00+539.2Ю.В. Земцова, Л.В. Фомина
Квазижидкое состояние воды на границе лед – диоксид кремнияВведение
Свойства кристаллических и аморфных водных льдов вызывают устойчивый интерес, что обусловлено рядом причин. Вода играет важнейшую роль в биологических процессах, и знание образуемых молекулами воды характерных структур может помочь в определении структур связанной воды в системах с белками и другими биологическими молекулами. Во-вторых, вода – одно из наиболее распространенных веществ во Вселенной, и изучение состояний, в которых она в принципе может находиться на других небесных телах или в межзвездном пространстве, представляет несомненный интерес. В-третьих, исследование воды имеет общетеоретическое значение, так как позволяет понять основные особенности строения и многообразия кристаллических форм многих других веществ с тетраэдрической координацией молекул (атомов), а также причины многообразия аморфных форм одного и того же вещества и закономерности фазовых переходов между ними, природу аморфизации кристаллов под давлением, природу твердотельной кристаллизации из аморфного состояния и многие другие вопросы общего характера.
Для некоторых водных льдов имеются близкие структурные аналоги среди других кристаллических веществ (рис. 1), построенных из тетраэдрически координированных атомов. Так, лонсдейлит (гексагональная модификация алмаза), вюрцит (ZnS) и высокотемпературный тридимит (SiO2) изоструктурны льду Ih; алмаз, высокотемпературный кристобалит (SiO2) и сфалерит (ZnS) изоструктурны льду Ic. Отметим, что в каркасах вюрцита и сфалерита атомы Zn и S чередуются в позициях, занимаемых в соответствующих им льдах Ih и Ic атомами кислорода, а в модификациях SiO2, изоструктурных кристаллическим льдам, вместо каркасов из атомов кислорода, связанных водородными связями, присутствуют подобные каркасы из атомов кремния, соединенных ковалентными связями [1, с. 64–84].Среди перечисленных выше изоструктурных соединений наиболее интересным в данном случае является диоксид кремния, это связано с его распространением в природе. Свободная двуокись кремния (иначе – кремнезем, кремневый ангидрид) встречается преимущественно в виде минерала кварца, который составляет основу обычного песка. Последний является одним из главных продуктов разрушения горных пород и одновременно одним из важнейших строительных материалов, мировое потребление которого составляет около 500 млн т ежегодно. На долю свободной двуокиси кремния приходится приблизительно 12% от массы земной коры. Гораздо большее количество SiO2 (около 43% от массы земной коры) химически связано в составе различных горных пород. Следовательно, земная кора более чем наполовину состоит из двуокиси кремния [2].
Наибольший интерес вызывают процессы взаимодействия на границах раздела воды или водных льдов с различными структурами SiO2.
Например, особое состояние воды зафиксировано физиками из Института металлов имени Макса Планка в Штутгарте. Они обнаружили, что на поверхности соприкосновения льда с диоксидом кремния возникает тонкий квазижидкий слой воды, плотность которой на 17% больше, а температура замерзания примерно на 15 градусов ниже, чем у обычной воды. Толщина слоя всего около двух нанометров. Однако вода в этом слое может инициировать активное таяние льда [3].
1. Моделирование и описание метода расчета
Из водных льдов наиболее стабильна модификация Ih, т.е. лед гексагональной структуры. Из модификаций кремнеземов наиболее стабильным является кварц, но в метастабильном состоянии способны также существовать такие модификации SiO2, как тридимит, кристобалит и аморфный диоксид кремния.
Предложены супрамолекулярные модели наноструктурных интерфейсов между гексагональной модификацией льда и различными модификациями диоксида кремния – аморфной модификацией и кристаллическими модификациями – кварцем, тридимитом и кристобалитом.Опишем физико-химические механизмы и закономерности для системы диоксид кремния – лед, которая имеет по всем трем направлениям нанометрический размер.
Расчет проводился в программе Hyper Chem ver 6.0 при помощи неэмпирических методов.
Неэмпирические расчеты основаны на точном решении уравнения
,
где
– энергия отталкивания ядер;
– энергия притяжения электронов к ядрам;
– энергия отталкивания электронов.
которые не включают никаких экспериментальных параметров, кроме фундаментальных физических постоянных. Затраты времени ЭВМ при выполнении неэмпирических расчетов даже с использованием минимального базиса АО значительно выше, чем для полуэмпирических методов, и быстро растут с увеличением размеров базиса АО. Благодаря быстрому прогрессу технических возможностей современных ЭВМ область приложений неэмпирических расчетов непрерывно расширяется. В современной теоретической химии неэмпирические расчеты молекул становятся постепенно общедоступными.
Одно из особенно важных достоинств неэмпирических схем расчета состоит в том, что легко установить их строгую иерархию, основанную на сопоставлении получаемых с их помощью значений полной энергии. Свойство вариационности неэмпирических методов дает возможность, улучшая постепенно форму искомой волновой функции, приближаться к результату, достигаемому вначале в хартри-фоковском пределе, а затем к результату, достигаемому точным решением уравнения Шрёдингера. Поскольку каждый шаг на этом пути сопряжен с быстрым нарастанием затрат машинного времени, исследователь останавливается на расчетной схеме той или иной степени сложности, обеспечивающей должный компромисс между желаемым уровнем точности решения и затратами машинного времени. Практика расчетов выработала определенные критерии для выбора подходящих при решении различных задач приближений неэмпирических расчетов.Выбор базисных атомных функций в разложении ЛКАО является важной задачей, так как именно им определяется, насколько точно ряд ЛКАО аппроксимирует молекулярную орбиталь Хартри-Фока. Этот ряд должен достаточно быстро сходиться, т.е. малое число атомных орбиталей должно аппроксимировать МО с требуемой точностью. Существует три основных критерия для выбора базисных функций:
1. Базисные функции должны давать в основном хорошее приближение к истинной волновой функции (например, возле ядер и на больших расстояниях от них).
2. Базисные функции должны допускать аналитическое вычисление нужных интегралов.
3. Полное число базисных функций не должно быть очень большим.
Простейший уровень неэмпирических расчетов – использование минимального базиса АО. Наиболее распространенным способом сжатия базиса является схема STO-NG – т.е. минимальный базис орбиталей, в котором N гауссовских функций использованы для аппроксимации одной слетеровской. В большинстве случаев ограничиваются N = 3, т.е. используют минимальный базис STO-3G, что мы и делали, так как при дальнейшем увеличении точность результатов растет очень медленно [4, с. 203–206].2. Компьютерный эксперимент и анализ полученных данных
Рассмотрим наноблок h30O10 со структурой льда Ih (кристаллическая фаза нормального давления, имеющая гексагональную структуру). По данным ab-initio расчетов внутримолекулярная водородная связь имеет длину 1,8 Å и энергию -36 кДж/моль.
Рассмотрим фрагмент нанослоевого интерфейса аморфной и кристаллических структур оксида кремния и льда Ih. Образование интерфейса на примере взаимодействия льда Ih и тридимита представлено на рисунке 2.
Моделируем интерфейс двух наноблоков Si10О20 и Н20O10, между которыми возникают водородные связи. Длина этих связей 2,6 Å, а энергия составляет -32 кДж/моль. То есть по энергии они близки к внутримолекулярным водородным связям.Несмотря на то, что энергия молекулярной водородной связи одинакова во всех структурах, число этих связей в интерфейсе различно и, как следствие, отличаются энергии адгезии. Наибольшей адгезионной энергией (-130 кДж/моль) с Н20O10 обладает аморфный диоксид кремния, так как он образует пять молекулярных водородных связей. Следующее место по величине энергии адгезии (-104 кДж/моль) занимает тридимит, который образует четыре таких же связи. Это возможно благодаря тому, что он изоструктурен льду Ih. Кристаллические модификации оксида кремния кристобалит и кварц имеют лишь по три молекулярных водородных связи, что соответствует энергии адгезии -78 кДж/моль. Такое количество связей обусловлено структурой этих модификаций.
Заключение
Взаимодействие различных структур водных льдов с различными структурами диоксида кремния интересно, прежде всего, в общетеоретическом плане. Понимание процессов, протекающих на границе различных сред, позволит в будущем создавать материалы с прогнозируемыми, заранее заданными свойствами. Кроме того, исследования в этой области уже сейчас могут принести практическую пользу. Например, явление квазижидкого слоя воды имеет большое значение для понимания процессов движения ледников и обледенения крыльев самолетов, а также существенно для изучения образования нефти и зарождения жизни. Становится возможным изучение синтеза сложных органических веществ из воды, метана и водорода при экстремальных условиях в нанопорах оксида кремния, которые являются природными наноавтоклавами. Библиографический список
- Желиговская, Е.А. Кристаллические водные льды / Е.А. Желиговская, Г. Г. Маленков // Успехи химии. – 2006. – 75(1).
- http://www.xumuk.ru/nekrasov/x-03.html
- www.nature.com/cgitaf/DynaPage.taf?file=/nature/journal/v428/n6982/abs/nature02449_fs.html
- Минкин, В.И. Теория строения молекул. / В.И. Минкин, Б.Я. Симкин, Р.М. Миняев. – Ростов-на-Дону, 1997
Рис. 1. Структурные аналоги льдов, среди других кристаллических веществ
Рис. 2. Образование интерфейса между наноблоками льда Ih и тридимита
www.birmaga.ru