Современные методы реабилитации после септопластики. Антибактериальная пленка для операции
Уникальная антибактериальная плёнка Hexis! / личный блог kipish / smotra.ru
Согласно неутешительной статистике каждый год, например в Европе, умирает примерно 50 000 человек именно от инфекций, полученных во время лечения основных заболеваний. Затраты, которые несет государство на лечение инфекций, которых можно было избежать путём дополнительных мер гигиены – колоссальны. Кроме того, каждый из людей в течение дня неоднократно контактирует с поверхностями, несущими микробов и грибки, потенциальную угрозу здоровью.
Ежедневная неоднократная обработка мест общего пользования, нуждающихся в максимальной стерильности, слишком ресурсоемка и дорога. Необходимо использование средства, которое могло бы на протяжении долгого времени проявлять бактерицидные свойства, и при этом быть достаточно мощным в борьбе с вредоносными бактериями на всём протяжении срока службы.
Французский производитель виниловых плёнок Hexis в 2010 году выпустил уникальный продукт – виниловую бактерицидную плёнку. Различные исследования, проведенные независимыми микробиологическими лабораториями (согласно стандарту ISO 22196), отметили снижение роста и размножения микробов и грибков более чем на 90%, что свидетельствует о ярко выраженных бактерицидных свойствах.
Принцип, по которому происходит обеззараживание среды, указан на схеме ниже.
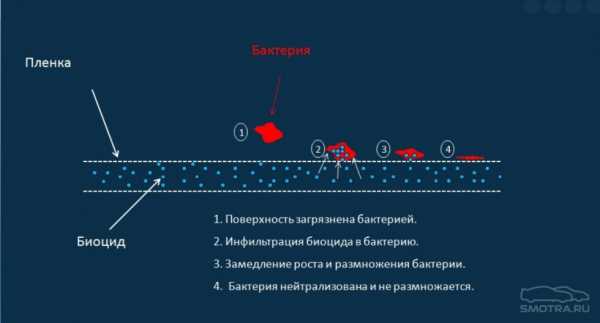 Плёнка ингибирует размножение широкого спектра микробов.
Плёнка ингибирует размножение широкого спектра микробов.
Сферы применения подобной плёнки в быту не ограничены практически ничем:- Помещения всех назначений в госпиталях, в том числе операционные;- Кухни и столовые;- Лаборатории;- Гигиенически чувствительные зоны;- Зоны массовых скоплений людей;- Сенсорные общественные мониторы;- Торговые площади;- Детские сады и многое другое.
 Использование плёнки, к примеру, на кухне может предотвратить развитие кишечной палочки.
Использование плёнки, к примеру, на кухне может предотвратить развитие кишечной палочки.
 Плёнку можно использовать на самых разнообразных поверхностях.
Плёнку можно использовать на самых разнообразных поверхностях.
Плёнка полностью прозрачна, не имеет запаха, безопасна при контакте с кожей и имеет хороший клеевой слой, что позволяет наносить ее практически на любые поверхности: стены, окна, двери, дверные ручки, мебель и другие ровные и гладкие поверхности. Температура эффективного действия – от 10 до 40 градусов Цельсия. Плёнка имеет чрезвычайно высокую устойчивость к огню (М1), что обеспечивает дополнительную безопасность ее эксплуатации.
 Вот так она выглядит.
Вот так она выглядит.
В использовании плёнка абсолютно неприхотлива и не нуждается в обслуживании. Тем не менее, её можно протирать обычными моющими средствами, медицинскими чистящими средствами или спиртом, что не повлияет на ее противомикробные свойства.Завод-изготовитель даёт гарантию 5 лет на противомикробный эффект своей плёнки. После того, как срок службы плёнки истечет, ее можно без проблем заменить на новую.
Есть два вида противомикробных плёнок:AM030 – Противомикробный ламинат толщиной 30 микрон. Продолжительность активного воздействия на микроорганизмы – 5 лет. Ширина – 1,37 м. Длина рулона – 45 м. Стоимость 1 кв.м. – 2100 р.AM060 – Противомикробный ламинат толщиной 60 микрон. Продолжительность активного воздействия на микроорганизмы – 5 лет. Ширина – 1,37 и 1,52 м. Длина рулона – 30 и 45 м. Стоимость 1 кв.м. – 3100 р.
Компания Re-Styling, являющаяся официальным дистрибьютором материалов Hexis на территории Российской Федерации, имеет эксклюзивное право распространения бактерицидной плёнки Hexis, поэтому приобрести её можно только у нас.
И помните, предовтратить болезнь намного проще, чем её потом лечить!
by M5Sergey.
P.S. Убедительная просьба не шутить по поводу оклейки автомобилей этими плёнками, плёнка эта не автомобильная
smotra.ru
ПЛЕНКА ХИРУРГИЧЕСКАЯ, СИНТЕТИЧЕСКАЯ АДГЕЗИВНАЯ, РАССАСЫВАЮЩАЯСЯ – БАРЬЕР TISSUE
Пленка хирургическая TISSUE специально разработана для использования в хирургии и применяется для предотвращения утечки воздуха, крови, иных жидкостей, путем герметичного закрытия необходимого участка поверхности ткани;
- данная пленка хирургическая изготовлена из синтетических материалов;
- для ее применения не требуется никакой подготовки;
- на поверхности ткани пленка хирургическая распределяется равномерно;
- благодаря уникальной технологии клей-полимера на поверхности ткани меньше чем за одну минуту создаются ковалентные связи с белками;
- еще одним преимуществом, которым обладает пленка хирургическая является то, что на месте расположения она поглощает воду, в результате чего образуется гидрогель;
- пленка хирургическая TissuePatch в естественных условиях разлагается полностью.
Хирургическая пленка TISSUE повсеместно применяется при проведении хирургических операций на открытой грудной клетке, гарантируя мгновенное устранение утечек воздуха, возникающих в процессе проведения операций на легких (TissuePatchthoracic). В нейрохирургии пленка хирургическая применяется в целях запечатывания и предотвращения протекания жидкости (в т.ч. спинномозговой жидкости) и/или потери крови там, где требуется восстановить твердую мозговую оболочку (TissuePatchDural). Кроме того, пленка хирургическая применяется в целях запечатывания, укрепления защиты от пропускания воздуха, мелких протеканий или выделений жидкости, контроля слабого кровотечения(TissuePatch4)
НЕ ТРЕБУЕТ ПОДГОТОВКИ:
Пленка хирургическая Tissue - не требует подготовки перед применением и в любой момент готова к использованию. В сравнении с жидкостями, пленка хирургическая Tissue является небольшим объемом инородного тела и гарантированно сохраняет одинаковую равномерную толщину по всей поверхности применения. Закрепляется к ткани пленка очень прочно.
ПАРАМЕТРЫ:
25*50мм, 50*50мм, 50*100мм, 100*100мм
Видео можно посмотреть здесь!
vonadi.com
Современные методы реабилитации после септопластики
 Назад
Назад Современная медицина обладает специализированными технологиями, позволяющими пациенту избежать неприятных ощущений после септопластики и дышать через нос.
Самой частой патологией лор-органов является искривленная перегородка носа. Никто не задумывается о том, что даже малейшее искривление может привести к серьезным заболеваниям, таким как синусит, полипы в носу. Почему это происходит? При здоровом состоянии лор-органов в нижние дыхательные пути попадает только чистый и согретый воздух, так как в носовой полости он согревается и дезинфицируется. При искривленной носовой перегородке все вышеперечисленные функции нарушаются из-за того, что струя воздуха ударяется об искривление перегородки.
Исправление искривленной перегородки носа называют септопластикой. Эта операция помогает больному вернуться к нормальному и естественному дыханию. Но, к сожалению, многие пациенты стараются ее избегать и продолжают жить с искривленной перегородкой, что впоследствии приводит к осложнениям. Многих людей волнует множество вопросов:
- как дышать после операции носом?
- будут ли ставиться тампоны в нос?
- сколько после операции мне нужно будет лежать в стационаре?
Эти вопросы останавливают пациента решиться на операцию.
Как проходит реабилитация после септопластики
С развитием современных технологий септопластика перестала быть дискомфортной. Операция начинается с того, что пациенту вводится наркоз, далее доктор при помощи эндоскопа через маленький разрез входит между листками слизистой и выпрямляет перегородку.
В реабилитационном периоде также были созданы специализированные технологии, позволяющие пациенту избежать неприятных ощущений и дышать через нос. Были созданы внутриносовые септальные шины по Рейтеру или сплинты. Они выполнены из мягкого силикона, так как он не причиняет никакого вреда организму и безболезненно удаляется из него. Сплинты имеют семигранную форму, которая полностью повторяет форму перегородки, место, где воздействует хирург. Суть сплинтов заключается в том, что они держат перегородку по средней линии. После операции, пока пациент находится под наркозом, пришивается силиконовый сплинт.
Сплинты бывают разной модификации. По форме носа они могут быть, как большими, так и маленькими. Между силиконом сплинта еще может вставляться трубка, через которую пациент сможет дышать сразу же после операции. Септальная шина стоит в носу около 5-7 дней, в результате чего носовая перегородка принимает свою позицию.
Септальные шины
В последнее время септальные шины или так называемые внутриносовые сплинты стали неотъемлемой частью операций на носовой перегородке. При септопластике, риносептоспластике и закрытии перфораций перегородки носа, завершающим этапом операции является установка септальных шин по обе стороны от перегородки носа.
Причиной излюбленности сплинтов у хирургов является ряд преимуществ, которые улучшают результат операции, снижают риск возникновения послеоперационных осложнений и ускоряют выздоровление пациента.
Преимущества септальных шин отражены в таблице
| Отделяемое в носу | После операции слизистое отделяемое в носу и остатки крови засыхают. Образуются корки в носовой полости, которые прилипают к слизистой перегородки носа. Корки удаляются с затруднением. Также они ухудшают дыхание и вызывают сильный дискомфорт у пациента в послеоперационном периоде | Септальные шины покрывают всю слизистую перегородки носа, тем самым не дают возможности образовываться коркам на слизистой перегородки носа. А благодаря тому, что они сделаны из силикона, все патологическое содержимое в носу не находит сцепления и легко смывается при носовом душе. |
| Отек слизистой | После операции слизистая оболочка носа из-за хирургического воздействия начинает отекать, тем самым закрывая носовые ходы. В результате чего пациент не может дышать носом, приходиться дышать ртом, так развивается сухость во рту и т.д. | Силиконовые сплинты не дают слизистой полости носа отекать и смыкаться, так как они очень гибкие и достаточно эластичные. А благодаря тому, что они имеют специальные каналы, такая проблема как затруднение дыхания после операции перестает быть актуальной. |
| Спайки в носу | Нередко после того как пациент приходит на повторный визит к доктору, ему сообщают об образовании спаек в носу (синехии). Причиной спаек в носу является то, что слизистая перегородки носа из-за отека начинает соприкасаться со слизистой боковой (противоположенной) стенки носа, в результате чего они слипаются, а пациенту это грозит дополнительной операцией. | Сплинты являются барьером между слизистыми и помогают избежать данного осложнения. |
| Повторное смещение перегородки после операции | Риск смещения высокий. | Сплинты как гипс, наложенный на переломанную конечность, держат перегородку носа строго по средней линии и придают ей дополнительную опору. Тем самым сплинты помогают избежать такого осложнения как вторично смещенная перегородка носа. |
| Носовое кровотечение | Носовые кровотечения достаточно частые. | Плотно удерживая перегородку носа по средней линии, сплинты сдавливают сосуды и предотвращают накопление крови между листками слизистой перегородки носа. Таким образом, частые осложнения как носовое кровотечение или гематома перегородки носа, с установленными сплинтами, не возникают. |
| Тампонирование | Тампонирование обязательно. Тампоны в носу создают дополнительный дискомфорт. | Удается избежать тампонирования полости носа. За счет этого реабилитационный период для больного протекает гораздо легче. Но все же следует помнить, что проводить тампонацию полости носа или нет, решает только хирург в зависимости от обстоятельств после установки сплинтов. |
Боль в носу в послеоперационном периоде
Нередко в послеоперационном периоде пациенты испытывают боль в области носа. Это связано как с самим хирургическим воздействием, так и с наличием тампонов в носу. В случае если боли сильно выражены, доктор может назначить опиоидосодержащие наркотические обезболивающие такие, как трамадол, промедол. Чаще всего пациенты сами отказываются от опиоидных анальгетиков. В таком случае врачи используют нестероидные противовоспалительные препараты: кеторол, диклофенка, анальгин. Однако противопоказанием данных препаратов является ухудшение свертываемости крови, и тем самым увеличение риска послеоперационных кровотечений, поэтому врачи не рекомендуют часто использовать эти препараты, особенно в первые дни после операции.
Для уменьшения болезненности после септопластики рекомендовано приподнимать головной конец кровати, если пациент проходит реабилитацию в стационаре. В домашних условиях нужно лежать с возвышенным головным концом, используя для этого 2-3 подушки. Также рекомендуется 2-3 раза в день прикладывать лед на 5-10 минут в область переносицы и лба.
В послеоперационном периоде не стоит трогать нос, особенно нужно избегать нажатий на кончик носа. Это может вызвать сильную боль и станет причиной ухудшения заживания тканей в послеоперационной области. Также травмирование носа после септопластики нередко вызывает смещение перегородки носа на сторону.
Антибиотики
В период реабилитации, для снижения риска инфицирования, доктор назначает антибиотики. Обычно это антибиотики пенициллинового ряда. Необходимо строго соблюдать продолжительность и дозу антибиотиков, выписанных доктором.
Сосудосуживающие препараты и носовой душ
На следующий день, после того как из носа удаляются тампоны, необходимо будет использовать сосудосуживающие капли для носа, например, ксилометазолин, називин и соленые растворы для носа (аква-лор, долфин). Сосудосуживающие препараты назначают для того, чтобы уменьшить отек в носу и расширить носовые ходы, тем самым обеспечивая проходимость носа при носовом душе соляными растворами. Соляные растворы вымывают слизь, застывшую кровь, корки из носа, ускоряя выздоровление. В среднем доктор назначает сосудосуживающие капли и носовой душ продолжительностью 5-7 дней.
Основные рекомендации для пациента
Важной рекомендацией в послеоперационном периоде является ходьба и обильное питье. Старайтесь избегать длительного пребывания в кровати. В течение дня 3-4 часа должно быть уделено умеренной ходьбе. Пить нужно до трех литров жидкости в стуки. Жидкость может быть в виде простой воды, соков, чая и.т.д. Данные действия ускоряют обмен веществ в организме и ускоряют выздоровление. Но ни в коем случае не нужно путать умеренную ходьбу с физическими нагрузками. Помните, физические нагрузки противопоказаны в течение 3-х недель реабилитации.
Септопластика в «Клинике Уха, Горла и Носа»
Врачи нашей клиники имеют богатый опыт проведения операций по септопластике. Современные методики, которыми обладают наши доктора, позволяют не только провести операцию с использованием последних достижений медицины, но и обеспечить комфорт клиента в послеоперационный период: существенно снизить болевые ощущения и дать возможность дышать сразу после хирургического вмешательства.Часто задаваемые вопросы по септопластике
Почему после операции необходимо устанавливать тампоны в нос? В конце операции доктор устанавливает тампоны в полость носа для предотвращения кровотечения. По этой причине первые сутки после операции нужно дышать через рот. Почему после операции течет кровь из носа? В послеоперационном периоде, несмотря на то, что в полости носа установлены тампоны, считается нормальным кровянистое отделяемое из носа в течение первых 12 часов после операции. Почему после операции появляется сухость во рту? После операции вы будете испытывать чувство сухости во рту. Это связано с использованием специальных медицинских препаратов во время наркоза. Почему нельзя сморкаться и чихать во время реабилитационного периода? Не рекомендуется сморкаться или делать чрезмерно сильные вдохи через нос в послеоперационном периоде. Это может привести к повреждению заживающих тканей, подвергшихся хирургическому лечению и привести к осложнениям. Если Вам захотелось чихнуть, то нужно чихать с открытым ртом, это поможет уменьшить напряжение в полости носа. Почему возникают кровоподтеки в области щек и век после операции? Редко, но все же встречаются такие послеоперационные явления, как небольшая отечность или следы кровоподтеков в области щек и век. Чаще такое встречается, если помимо перегородки носа было выполнено хирургическое воздействие и на околоносовые пазухи. Обычно отечность нарастает на второй день и в течение следующих 5-6 дней начинает спадать. Послеоперационные отеки и кровоподтеки не говорят о качестве операции и никак не влияют на послеоперационный результат. На какой срок устанавливаются сплинты? После удаления тампонов из полости носа, в носу будут оставаться силиконовые сплинты. Обычно они устанавливаются на протяжении от 3 дней до 2 недель, в зависимости от целей, поставленных хирургом. Внимательно ознакомьтесь с инструкцией доктора о том, как прочищать сплинты в случае их загрязнения. Сколько раз после операции нужно приходить к доктору? В среднем в реабилитационном периоде необходимо 3-4 визита. Очень важно в послеоперационном периоде приходить к доктору на осмотр и туалет полости носа. Это способствует ускорению восстановления дыхательной функции носа. Почему после септопластики из горла и носа течет розоватая жидкость похожая на кровь? В течение нескольких дней после операции из носа, а также из горла может отходить розовато-красноватая жидкость, так называемое сукровичное отделяемое. Со временем количество такого отделяемого уменьшиться до полного прекращения. Но не стоит путать такое отделяемое с кровотечением, которое также нередко встречается после операции. Если вы отмечаете длительное кровотечение из носа, необходимо немедленно обратиться к доктору. Что делать если после тампонации нос очень сильно болит? После операции пациенты предъявляют жалобы на дискомфорт, вызванный наличием тампонов в носу. В случае болезненных ощущений необходимо принимать обезболивающие препараты, назначенные доктором. Что делать если образовавшиеся корки в носу доставляют болезненные ощущения или мешают? Можно аккуратно очищать корочки вокруг ноздрей, не влезая вовнутрь. Делается это с помощью ватных палочек, смоченных в 3% растворе перекиси водорода. После операции очень болят уши и голова, с чем это связано? Вы можете ощущать дискомфорт в области ушей и головы, это является нормальным послеоперационным фактором. В данном случае нужно попросить врача подобрать обезболивающее средство. Каков риск попадания инфекции в полость носа после септопластики? После септопластики риск инфицирования послеоперационной раны очень мал. Однако, если вас беспокоит боль в носу, отек, покраснение в области носа и температура тела, повышающаяся до 38 градусов Цельсия, это может быть признаком инфекции. Об этом необходимо сообщить доктору и прийти на осмотр. Почему после септопластики болит горло? Одной из частых жалоб после операции является боль в горле. Это связано с тем, что во время наркоза в горло устанавливается специальная трубка. После ее удаления могут оставаться неприятные ощущения в горле. Обычно ощущения проходят в течение нескольких дней. После септопластики немеют губы и зубы. С чем это связано? Чувство онемения в области зубов и верхней губы нередко беспокоит пациента. Это связано с отеком нервных окончаний в данной области. Этого не стоит бояться. Обычно чувствительность возвращается в течение нескольких недель. Чего необходимо избегать в реабилитационном периоде? Необходимо после операции ограничить физические нагрузки в течение 2-3 недель, избегать наклонов головой вниз, не поднимать тяжелые предметы, не тужиться. Избегать горячих водных процедур (бани, сауны и т.д.). Можно ли курить во время реабилитационного периода? Курение в послеоперационном периоде также противопоказано. Также противопоказано нахождение в помещениях с табачным дымом, так как это вызывает отек и ухудшает заживление оперированных тканей. Сколько стоит воздерживаться от алкоголя после операции? Категорически нельзя употреблять алкогольные напитки в течение первых 10 дней после операции – при употреблении алкоголя риск кровотечения из оперированных поверхностей увеличивается в разы!Опубликовано: 12.06.2016 12:40:33
www.lorlor.ru
Обработка операционного поля
Накануне операции кожа в области предполагаемого оперативного вмешательства тщательно моется водой с мылом, а при ортопедических операциях и операциях с оставлением в ране крупных инородных тел (штифты, сетки, искусственные суставы и другие конструкции), после механической очистки кожи, операционное поле обрабатывается антисептиком и закрывается асептической повязкой.
Утром в день операции волосы в области операционного поля широко сбривают сухим способом и протирают спиртом.
При экстренных операциях и сильном загрязнении кожу моют щеткой с мылом, при загрязнении нефтепродуктами очищают эфиром, спиртом или бензином. Волосы также сбриваются.
Для обработки кожи операционного поля используются:
1% раствор йодоната,
0,1% раствор йдопирона,
0,5% раствор хлогексидина биглюконата,
раствор первомура.
Обработка кожи производится путем двукратного смазывания антисептиком до обкладывания стерильным материалом, смазывания кожи перед разрезом, смазывания кожи перед наложением швов и смазывания кожи после наложения швов. Применение растворов иода для обработки операционного поля запрещено 720 приказом МЗ.
Изоляция операционного поля специальными пленками
В последние годы для изоляции операционного поля используются специальные стерильные клеющиеся пленки, которые накладываются на обработанную антисептиком и высушенную кожу в натянутом состоянии. Разрез кожи производится через пленку. Перед наложением швов пленка отклеивается, а кожа обрабатывается антисептиком.
Профилактика имплантационной инфекции
Стерилизация шовного материала
В настоящее время в хирургии применяется шовный материал разового использования, который поступает в упаковке, уже простерилизованным лучевым методом в заводских условиях. В основном это атравматические нити, снабженные колющими или режущими иглами Также стерилизуются и обычные нити без иглы. Они поступают стерильными в виде мотков в герметичных стеклянных ампулах в растворе антисептика.
Нити могут быть рассасывающимися, такими как кетгут, дексон, викрил. Обычный кетгут рассасывается в организме через 2-3 недели, хромированный кетгут и синтетические рассасывающиеся нити - через 1-2 месяца.
Нерассасывающиеся нити (шелк, капрон, лавсан и пр.) остаются в организме на многие годы.
Поступающие нестерильными синтетические нити - капрон, нейлон, дакрон, лавсан и др. стерилизуются в автоклаве, в отдельном биксе. Режим стерилизации такой же, как и для операционного белья. Также стерилизуются, используемые для наложения швов, металлические скрепки, клеммы, клипсы, которые изготовлены из титана, тантала, нержавеющей стали и других сплавов.
Классические способы стерилизации шелка (метод Кохера) и кетгута (методы Ситковского, Губарева и Клаудиуса) в настоящее время практически не применяются, однако, возможны ситуации, когда применение каждого из этих методов может оказаться вынужденным.
Стерилизация шелка
Для стерилизации шелка используется метод Кохера. Мотки шелка заливают для обезжиривания эфиром на 12 часов, затем нити высушивают на стерильной простыне, после чего переносят в стерильную банку с 70% спиртом на 12 часов. Заканчивают стерилизацию кипячением в растворе сулемы 1:1000 в течение 10 минут. Хранят шелк в 96% спирте, в банках с притертыми пробками, Через 2 суток берут кусочек шелка для бактериологического исследования.
Стерилизация кетгута
Существует несколько способов стерилизации кетгута.
Сухая стерилизация в парах йода по Ситковскому. Кетгут обезжиривают ,опуская в эфир на 12 часов, затем протирают марлевым тампоном, смоченным сулемой 1:1000, после чего опускают в 2% раствор йодида калия на 30 – 60 секунд. Обработанные таким образом нити сматывают в колечки и помещают в стерильную стеклянную банку, где они обрабатываются парами йода от 3 до 5 суток в зависимости от толщины нити. Хранят кетгут в стерильной банке.
Стерилизация в водном растворе Люголя – способ Клаудиуса.
После обезжиривания в эфире (12 часов) мотки кетгута помещают водный раствор Люголя на 16 суток (дважды по 8), затем перекладывают в банк с 96% спиртом на 4-6 суток, после чего берут посев на стерильность. Хранят кетгут в 96% спирте.
Стерилизация в спиртовом растворе Люголя – способ Губарева.
После обезжиривания в эфире в течение 12 суток кетгут погружается в спиртовой раствор Люголя на 14 суток (дважды по 7 суток) и если он стерилен его можно использовать. Хранят кетгут в спиртовом растворе Люголя, меняя его каждые 7-10 суток.
Стерилизация конструкций для протезирования и трансплантатов
Для остеосинтеза при переломах костей используются металлические конструкции – пластины, штифты, шурпы, винты, спицы и др., которые остаются в организме человека на длительный срок, или навсегда. Они стерилизуются в автоклаве или сухожаровом шкафу также, как и металлические инструменты.
Конструкции, включающие и пластмассовые детали (протезы клапанов сердца, суставов, кава - фильтры и т.п.) стерилизуются химическим или газовым способом.
Стерилизовать органы и ткани, взятые для трансплантации каким- либо из перечисленных выше способов не представляется возможным по понятным причинам, поэтому профилактика имплантационной инфекции достигается строгим соблюдением правил асептики и антисептики при взятии материала. Материал берется в условиях, приближенных к условиям операционной. Орган, извлеченный в стерильных условиях, промывается стерильным раствором и помещается в специальный герметичный, стерильный контейнер, обложенный льдом, и транспортируется к месту его использования.
studfiles.net
Антибактериальное нанопокрытие имплантов для профилактики инфекционных осложнений
Ученые из университета Джона Хопкинса создали и протестировали на лабораторных животных нановолоконное покрытие с антибиотиками, которое планируют использовать для искусственных суставов и пластин с целью предупреждения бактериальной инфекции.
Ученые утверждают, что технология может использоваться в различных областях медицины – травматологии, ортопедии, кардиологии, стоматологии и др. В отличие от существующих покрытий, новый материал содержит комплекс антибиотиков. Это предотвращает инфицирование и развитие бактериальной флоры.
Уж много лет хирурги и биомедицинские инженеры ищут наилучший способ снижения уровня бактериального инфицирования. Банальная инфекция является наиболее распространенным осложнением при постановке искусственных коленных, тазобедренных и плечевых суставов.
Каждый год только в одних США проводят до миллиона операций по установке тазобедренных и коленных суставов. Из них 2% осложняются бактериальной инфекцией. Микроорганизмы формируют на поверхности суставов биологические пленки, плотные образования из белков, углеводов и ДНК, которые невозможно уничтожить.
Сразу после операций остеосинтеза, эндопротезирования суставов, острую бактериальную инфекцию подавляют с помощью внутривенного вливания антибиотиков. Иногда процесс переходит в хроническую стадию. В таких случаях имплантат удаляют, назначают длительный курс лечения антибиотиками, затем вновь предстоит операция по установке эндопротеза. Один курс лечения для избавления от биопленок составляет в США около 100 тысяч долларов.
Негативные побочные эффекты стараются побороть с помощью локального использования антибиотиков. Медикаменты примешивают в цемент, наносят в виде порошка или микрошариков на поверхность медицинских устройств. Однако желаемый результат не достигнут из-за отсутствия контроля над распространением препарата. А также невозможности использовать несколько видов антибиотиков. Новая технология поможет решить эти проблемы.
На протяжении трех лет ученые разрабатывали тонкое пластиковое покрытие, которое может освобождать несколько типов антибиотиков с различной скоростью. Покрытие представляет собой тонкую сеть из нановолокон на пленке. Все компоненты состоят из биоразлагаемых полимеров, которые давно используются в шовном материале, костный пластинах и системах доставки лекарств.
Для проверки возможности покрытия в предотвращении инфекции при эндопротезировании ученые «напитали» нановолокна рифампицином в комбинации с ванкомицином и даптомицином. Нановолокна были рассчитаны на выделение ванкомицина с даптомицином от 7 до 14 дней и римфамицина – от 3 до 5 дней.
Руководитель проекта Ллойд Миллер говорит: «Римфапицин отлично справляется с биопленками, но не может использоваться в чистом виде из-за того, что бактерии быстро вырабатывают к нему устойчивость. Комбинация антибиотиков решает проблему резистентности».
Новое покрытие было испытано на спице Киршнера – тип штифта, который используется в ортопедической хирургии для фиксации костных отломков. Спицы поместили в коленные суставы лабораторных крыс, предварительно осеменив золотистым стрептококком. Это бактерия наиболее часто становится причиной хронический инфекции в ортопедической хирургии. В генетический код бактерии был внедрен люминесцентный ген, который позволил отслеживать рост бактериальной колонии.
По сообщениям профессора Миллера на 14 день после операции у всех мышей в контрольной группе регистрировалось инфицирование всех тканей вокруг сустава, причем 80% бактерий находились на поверхности штифта. В то же самое время у мышей со штифтами с защитным покрытием не было обнаружено ни одного признака инфицирования и роста бактерий.
Профессор Миллер говорит: «Этим покрытием нам удалось полностью уничтожить бактерии. Другие подходы и методики позволяют только уменьшить количество бактерий и лишь затормозить воспалительный процесс».
После двух недель штифты и окружающие ткани были изъяты для дальнейших исследований. Ученые обнаружили, что новое покрытие не только предотвратило распространение инфекции, но также снизило потерю костной массы вокруг штифта.
Профессор Миллер подчеркнул, что необходимы более широкие исследования для тестирования безопасности и эффективности нового покрытия на имплантируемых устройствах, предназначенных для человека. А также разработка оптимальной комбинации антибиотиков для различных случаев – при первой постановке искусственного сустава, повторной установке, при наличии хронического очага инфекции и многое другое.
Результаты исследования опубликованы в Proceedings of the National Academy of Sciences.
replaced.ru
replaced.ru
Эндопротезы, Герниопластика, Сетки для лечения грыж
И.В.Фёдоров, А.Н.Чугунов Кафедра эндоскопии, общей и эндоскопической хирургии Казанской государственной медицинской академии
С первых шагов радикальной хирургии грыж, положенной Бассини (Bassini) в 1887г.[10], рецидивы досаждали и расстраивали хирургов всех возрастов, разного опыта, степени мастерства и национальности. На протяжении последнего столетия даже самым ярым сторонникам пластики собственными тканями стала понятной необходимость в некоторых случаях использования синтетических материалов для закрытия дефектов брюшной стенки. Эндопротезы замещают несостоятельные собственные ткани брюшной стенки, а также позволяют выполнить герниопластику без натяжения.
По данным симпозиума «Актуальные вопросы герниологии», прошедшем в октябре 2001г. в Москве, за 2000 год в Европе было выполнено около 1мл операций при паховых грыжах. Из них – 86% - без натяжения с использованием сетчатого протеза (лапароскопическим и «открытым» способами). А также 230000 операций при вентральных грыжах, из них – 75% - без натяжения.
Из операций при паховых грыжах, выполненных без натяжения, 68% вмешательств сделано по методу Лихтенштейна, 22% - лапароскопическим доступом , 7% - с использованием тампона по Руткову и 3% - другими способами.
В данном небольшом обзоре литературы мы представляем Вашему вниманию столетнюю эволюцию использования протезов в герниологии.
Металлические протезы
Серебряные нити
Первым серебряную проволоку для пластики пахового канала использовал Фелпс (Phelps) в 1894г.[57]. Эта концепция была развита немецкими хирургами Витцелем (Witzel) [71] и Гоупелом (Goepel) [34], которые использовали для ушивания грыж филигранную серебряную проволоку (филигранность – термин, имеющий отношение к изящной тонкой работе с серебром или золотом). Серебро стало первым сетчатым материалом, используемым в герниологии. Существовало множество вариантов плетения. Грубое по сегодняшним параметрам, серебро, тем не менее, очень прочное и хорошо очищенное вещество, даже в сравнении с современными материалами. Мейер (Meyer) в 1902г.[51] и Бертлетт (Bartlett) в 1903г.[9] использовали различные методы плетения и доложили о небольшой удачной серии операций в американской литературе. При этой методике один слой сетки укладывали глубоко и подшивали к поперечной фасции и пупартовой связке серебряными нитями. Второй слой укладывали над семенным канатиком, и под апоневроз наружной косой мышцы. Так в 1920-1940гг. 23% операций в морском госпитале США выполняли с использованием серебряного имплантанта [20]. Бэлл (Ball) из Мельбурна в 1958 г. доложил об использовании большой серебряной сетки, расположенной преперитонеально и укрепляющую заднюю стенку пахового канала [8]. На 500 операций он сообщил лишь о 2 рецидивах и это укрепило мнение о необходимости преперитонеального расположения протеза в герниологии. Несмотря на эти результаты, использование серебра постепенно стало ограничиваться из-за чувства дискомфорта, возникающего у пациентов, недостаточной гибкости сетки и тенденции к отвердеванию. Также наблюдалась недостаточная инертность по отношению к тканям человека, что приводило с развитию сером, требующих дренирования с последующим возможным инфицированием. Появление биоматериалов положило конец использованию серебра в герниологии.
Танталовая сетка
Тантал совершенно резистентен к кислотам и щелочам, поэтому не вызывает никакой тканевой реакции. Он обладает высокой прочностью, эластичностью, податливостью, позволяющей вытягивать его в тонкую нить и плести сеть. Танталовая нить стала популярна в 1948 году. В 1951г. Кунц (Koontz) cообщил о 77 пациентах с большими прямыми паховыми грыжами, оперированными с использованием этой сетки и одним рецидивом через 25 месяцев [43]. В 1951г. Флинн (Flynn) доложил о 45 вентральных грыжах, оперированных с танталовыми сетками и одним рецидивом через 4,5 года [31]. Недостатки выявились много позднее и состояли в ломкости сетки из-за усталости металла. Больные на поздних сроках жаловались на дискомфорт в области сетки, неровность контуров брюшной стенки и даже возникновение рецидивов в области разрушенной сетки. Образование сером также не было редкостью, а удаление сетки при необходимости было большой сложностью из-за глубокого её окружающими тканями.
Безупречная (нержавеющая) сталь
Сети или экраны из нержавеющей стали начали использовать в 20-е годы. В 1952г. Бебкокк (Babcock) внедрил этот материал в герниологию, для ушивания грудной стенки, в ортопедических процедурах и косметической хирургии [7]. Ранние исследования на собаках показали отсутствие отторжения или формирования обширных рубцов при ушивании брюшины на сроках 2 недели. Далее стали применять крупноячеистые сетки из колец диаметром от 3-4 до 10-11мм. Престон (Preston) и Ричардс (Richards) в 1973 доложили о 2000 случаях за 24-летний период лечения грыж при помощи нержавеющей стали [58]. Они продемонстрировали её прочность, резистентность и толерантность в инфекции, отсутствие проблемы затвердевания и усталости металла, хорошую переносимость пациентами. Частота инфицирования составила 0,1%, не было рецидивов или других нежелательных явлений. В 1986г. Валидайре (Validire) сообщил о 150 случаях лечения больших послеоперационных вентральных грыж сближением апоневроза при помощи сетки [67]. Он получил хороший результат в ближайшем послеоперационном периоде у 90% больных и у 95% - на сроках более 4 лет.
Неметаллические синтетические протезы
В 1959г. Кунц (Koontz) и Кимберли (Kimberly) сказали: «Мы полагаем, что одна из наиболее серьёзных проблем в хирургии – создание неметаллических нерассасывающихся материалов, которые могут быть использованы для ушивания протезирований и которые не боятся инфекции»[44]. В своём опыте на собаках они апробировали различные материалы в септических и асептических условиях. В своих исследованиях они использовали Дакрон, нейлон, стекловолокно, майлар (искусственная плёнка для магнитофонов), орлон, полиэтилен, поливиниловую губку, полиэтилен, винион. В асептичных условиях материя из Орлона показала лучшую инфильтрацию фибробластами и прочность в сравнении с другими материалами. Хорошая инфильтрация была и у Дакрона, стекловолокна и нейлона, но прочность была меньше. Однако при наличии инфекции у всех этих материалов наблюдалось отторжение на фоне формирования абсцессов.
Ткань из Фортисана
Нарат (Narat) and Хедро (Khedroo) в 1952 чтобы преодолеть недостатки тантала и нержавеющей стали, предложили биологически инертный материал из целлюлозы – Фортисан [54]. Однако при наличии инфекции этот материал отторгался с формированием сером и абсцессов. Этот материал никогда не использовался в клинике.
Поливиниловая губка
Поливиниловая губка (Ивалон) – это полимер из поливинилового алкоголя с формальдегидом в который вдувают воздух через жидкий пластик для придания определённой формы. Впервые этот материал был использован в 1949г. для пломбировки бронхов после пневмонэктомии у собак [36]. Была показана низкая реакция отторжения и хорошая проростаемость фибробластами с формированием прочной фиброзной ткани. Было рекомендовано клиническое применение. В 1957г. Абрахамс (Abrahams) опубликовал опыт лечения 16 рецидивных грыж [1]. Они использовали поливиниловую губку толщиной 2мм. Протез подшивали по краю дефекта с умеренным натяжением. Было 2 нагноения с выздоровлением и отсутствие рецидивов через 30 месяцев. Однако при наличии инфекции этот материал не подходит для лечения грыж. Адлер (Adler) показал, что все достоинства Ивалона исчезают in Vivo, что материал плохо устойчив к инфекции находясь в тканях человеческого организма, может фрагментироваться и растворяться со временем [4].
Нейлон
Нейлон, как шовный материал хорошо известен хирургам как прочный материал, который вызывает минимальную реакцию и широко используется в различных областях хирургии. Техника использования нейлона в виде сетки для ушивания без натяжения задней стенки пахового канала была описана впервые Малони (Maloney) в 1948 [49]. Спустя 10 лет он доложил об 1% рецидива у 253 больных при наблюдении на сроках более 5 лет [50].
Кэлюм (Callum) в 1974 доложил о 7.5% рецидиве на 186 пациентов через 12 лет [16]. Абрахамсон (Abrahamson) выполнил ушивание у 780 пациентов за 10-летний период в 1988г. с частотой рецидивов 1.8% на сроках не менее 3 лет [2].
Большой материал опубликовали Доран (Doran), Гиббинс (Gibbins) и Уайтхед (Whitehead). С различными видами нейлона в 1961г. они установили, что тонкая сеть у 86 пациентов дала 1,2% нагноений, но с рецидивом 20% через 2 года [28]. Толстая нить использована всего у 15 больных с числом нагноений 53%. Средняя нить применена в 212 случаях с частотой нагноений 2.8% и с частотой рецидива 4.7% через 2 года. У всех 6 пациентов с нагноением потребовалось удаление сетки.
Крон (Kron) в 1984г. доложил об использовании французской нейлоновой сетки с преперитонеальным расположением при двухсторонних паховых грыжах [45]. У него не было рецидивов и серьёзных гнойных осложнений на 200 больных.
Кунц (Koontz) показал, что при отсутствии инфекции нейлон даёт хорошее прорастание соединительной тканью, но при наличии инфекции он неудобоворим [44]. Кроме того, находясь в тканях нейлон разрушается и теряет свою прочность на 80%, подвергаясь гидролизу и денатурации in vivo.
Силастик
Силастик – это полимер, в котором чередуются силиконовые и кислородные атомы, расположенные разветвлёнными группами.
Протезы для укрепления брюшной стенки производят, комбинируя силастик с Дакроном или нейлоновой сеткой, расположенными как бутерброд между двумя слоями силастика. Это достаточно толстый материал, который вызывает минимальную воспалительную реакцию. Этот материал применяют только в педиатрии для коррекции больших пупочных грыж или закрытия дефектов брюшной стенки другого генеза в педиатрии [60].
Тефлон
Тефлон (политетрафлюороэтилен) – наиболее популярный и известный своей не смачиваемой поверхностью в кулинарии, и уникальной способностью не пропитываться водой. Он никогда не прилипает и эта его удивительная химическая способность быть инертным позволила использовать его как биоматериал в хирургии. Он не вызывает воспаления и тканевой реакции. В 1959 Ладингтон (Ludington) and Вудвард (Woodward) использовали его для ушивания дефектов брюшной стенки у 26 пациентов [48]. Основываясь на 6-12 месячном безрецидивном течении они рекомендовали сетку из тефлона в клиническую практику. В 1964г. Гибсон (Gibson) and Стеффорд (Stafford) доложили о применении тефлона у 25 больных с большими или рецидивными вентральными грыжами [32]. У 50% возникли раневые осложнения, а у 5 потребовалось удаление сетки. Они сделали вывод, что энтузиазм по поводу использования тефлона был преждевременен.
В 1968 Копелло (Copello) из Аргентины сообщил о применении тефлона при осложнённых рецидивных паховых грыжах [21]. На 35 больных за 2 года не было нагноений или образования свищей, не потребовалось резеция или удаление всей сетки. Не было рецидивов.
В 1974 Кесбек (Kalsbeek) сообщил о серии из 34 пациентов с вентральными грыжами, прооперированными с тефлоновой сеткой [41]. Лечение было неудачным у 12 из 34 на сроках 4.5 года, у 10 образовались свищи.
Блонди (Blondiau) в 1979 описал 56 случаев лечения рецидивных двухсторонних паховых грыж тефлоновой сеткой [15]. 48 больных прослежены на сроках от 6 до 42 мес. Не было рецидивов или инфекции.
Лечение вентральных грыж с использованием тефлона интраперитонеально выполнено Дрюатом (Druart) в 1988 у 23 пациентов [29]. Через 18 месяцев был всего 1 рецидив. Тефлоновая сетка, расположенная преперионеально, на удивление хорошо переносилась пациентами.
Ван Ойен (Van Ooijen) в 1989 выполнил 58 операций при рецидивных грыжах [68]. Через 5 лет рецидив возник у 5 (9%), у 1 развилась глубокая раневая инфекция, потребовавшая удаления тефлона. В дальнейшем число неудач и рецидивов у них было минимальным.
В 1992 Мозинго (Mozingo) сделал 100 операций при рецидивных грыжах у 84 больных с преперитонеальным расположением сетки [53]. Наблюдали 3 рецидива, во всех случаях протез соскользнул. На сроке 5 лет не было инфекции или тестикулярных осложнений. Несмотря на некоторые успехи, особенно при интраперитонеальном и предбрюшинном расположении сетки, тефлон не срастается с тканями организма, неустойчив к инфекции и даёт слишком большое число раневых осложнений для того, чтобы быть рекомендованным к рутинному использованию в лечении паховых грыж.
Углеродистое волокно
Гибкая волокнистая углеродистая нить, которая может выпускаться в различных формах как хирургическим имплантат, хорошо толерантна к живым тканям и привлекает значительным прорастанием фибробластами с образованием плотной фиброзной ткани. Материал широко применяют в ортопедии.
В 1980г. Джонсон-Насе (Johnson-Nurse) провел большое экспериментальное исследование на овцах при грыжах сравнивая Дакрон и углеродистую сетку [40]. Он установил, что углерод обладает хорошей тканевой толерантностью с сильным стимулом к формированию коллагена даже внутри матрикса сетки.
Были сомнения по поводу канцерогенного действия такой сетки, памятуя о роли угольной пыльцы при раке лёгкого. Позже были проведены исследования на крысах на предмет канцерогенного действия углерода на ткани и это не было подтверждено на сроках 17 мес [63].
Гринстейн (Greenstain) в 1984 провёл экспериментальное исследование на крысах по использованию поликрилатной полимерной углеродной сетки при вентральных грыжах [37]. Им были получены удовлетворительные результаты.
В 1985 Кемерон (Cameron) сравнил на крысах углеродистую сетку с полипропиленовой [17]. Тензиометрия показала отсутствие разницы в прочности обеих сеток, тогда как тканевое прорастание в первом случае было значительно больше. В последующем в эксперименте было показано, что углеводородные волокна обладают прекрасной биосовместимостью и приводят к образованию новой соединительной ткани, сходной по своим свойствам с обычными связками человеческого организма.
К сожалению, до сих пор нет клинических результатов, подтверждающих эффективность и безопасность использования углеродной сетки на отдалённых сроках.
Полиэстеровая сетка Дакрон
Полиэстер – это полимер из этилен гликоля и терефталевой кислоты – был синтезирован в 1939 и внедрён в США в 1946 [38]. В конце 50-х, этот материал, известный как Дакрон, был фабричным способом превращён в сети и выпущен фирмой Этикон под названием «Марсилен».
Волстенхолм (Wolstenholme) в 1956 выполнил с Дакроном 15 операций при паховых и 4 – при вентральных грыжах с хорошим непосредственным результатом без раневых осложнений [73].
Беллис (Bellis) в 1969 сообщил о 3000 случаях использования Марсилена для свободной герниопластики под местной анестезией [12]. Неудача получена всего в 19 случаях, удаление сетки потребовалось у 14 больных.
Дардети (Durdeti) и Пембертон (Pemberton) в 1974 использовали Мерсилен у 96 больных с большими прямыми паховыми грыжами с одной серомой, одним рецидивом и отсутствием нагноений [30]. В группе из 13 пациентов с большими послеоперационными вентральными грыжами и пластикой Дакроновй сеткой в виде «мостика» осложнения включали 5 сером и одно нагноение. Рецидивы отсутствовали. Отдалённые результаты прослежены на сроках от 2 до 5 лет. Не было осложнений, связанных с фрагментацией имплантанта, отторжения сетки или болей в области протеза. Ими было установлено, что Дакрон обладает многими свойствами идеального протеза для грыжи.
Полиэстеровая сетка была использована Абуль-Хаcном (Abul-Husn) в 1974 для ушивания 23 грыж [3]. Он установил, что сетка удобная, лёгкая, прочная и гибкая, эластичная, подлежит автоклавированию и хорошо связывается. Хирург может ножницами легко предавать её любую форму без разволокнения краёв. Он сообщил об одном рецидиве на 16 паховых герниопластик, и отсутствия таковых на 2 пупочных и 5 вентральных грыж.
Кейсебот (Casebolt) в 1975 сообщил об использовании сетки у 35 пациентов [18]. Он оперировал при разных грыжах и наблюдал 2 рецидива в среднем через 36 мес. Небольшие раневые осложнения наблюдали в 14% случаев, и 8% развития глубокой инфекции с включением сетки.
Стоппе (Stoppa) описали использование очень большого не подшиваемого Дакронового протеза при ушивании трудных паховых грыж с преперитонеальным расположением протеза через нижний срединный доступ в 1975 [62]. В 1989 они же доложили о присутствии 1,4% рецидива на 604 ушивания на отдалённых сроках.
Серайсе (Cerise) использовал Мерсилен при 100 грыжесечениях (87 паховых и 13 вентральных) с одним рецидивом через 5 лет и одним серьёзным осложнением, состоящим в рецидивирующем абсцессе и формировании полости 20 месяцев спустя после операции [19].
Используя сканирующий электронный микроскоп в 1976 Минц (Minns) and Тинклер (Tinckler) исследовали поперечную фасцию и Мерсиленовую сетку для анализа их структурных повреждений [52]. Оказалось, и это не удивительно, что фасция при грыже слабее нормальной фасции, а сетка – прочнее каждой из обеих фасций.
В 1985г. Ван Дем (Van Demme) сообщил о серии в 100 операций преперитонеальным доступом [47]. Рецидивная грыжа исходно присутствовала у 49% больных. Используя технику, сходную со Stoppa, которая сейчас известна, как «гигантское укрепление протезом висцерального мешка» (GPRVS), он использовал Дакроновую сетку со 100% успехом – одним свищем, одной гематомой и двумя гидроцеле. Автор считает, что при отсутствии технических ошибок рецидивов не бывает. При классической герниопластике, однако, рецидив возможен даже при безупречной технике, даже много лет спустя, так как результат не полностью зависит от хирурга. А также из-за значительного растяжения тканей и натяжения, которому они подвергаются в результате операции.
В 1987 Адофф (Adloff) and Арнауд (Arnaud) описали технику хирургического лечения больших вентральных грыж с интрапариетальным использованием Марсиленовой сетки совместно с пластикой передней стенкой влагалища прямой мышцы живота [6]. 130 больных наблюдались на сроках от 1 до 8 лет, было 6 рецидивов (4.5%), которые были связаны с латеральным смещением сетки. Более 90% больных, перенесших операции при этих гигантских грыжах, полностью выздоровели.
В 1989 Уонтс (Wantz) доложил результаты использования GPRVS при 237 паховых грыжах у пациентов с высоким риском рецидива [70]. Он применял мерсиленовый протез и заключил, что Дакрон – сетка выбора для этой процедуры, так как она не сворачивается и не сгибается в преперитонеальном пространстве. Было 9 рецидивов, большинство – в первые 6 месяцев после операции, все успешно реоперированы. Пять рецидивов связаны с недостаточной фиксацией сетки хирургов и 4 – из-за неправильного её расположения. Осложнений было мало и число рецидивов было незначительно мало – 3.7%.
Зилл (Thill) и Хопкинс (Hopkins) cравнили использование Марсилена с операцией Бассини у 303 больных при 364 грыжах [64]. Число осложнений было сходным, но % рецидивов через 5 лет составил 11.5 после операции Бассини и 3.3 после использования сетки из полиэстера.
Сетка из Дакрона стала первой популярной неметаллической сеткой, и она широко используется сегодня, хотя в последние годы и стала менее популярна из-за повсеместного использования полипропилена.
Полипропиленовая сетка
Ушер (Usher) внедрил новую полипропиленовую пластиковую сетку, названную Марлекс-50, в серии экспериментальных и ранних клинических исследований в 1958-59гг. он применял различные виды пластик на собаках и установил, что Тефлон и Марлекс дают меньшую реакцию отторжения, чем нейлон, Орлон или Дакрон [65]. Он описал этот новый материал, как прочный и эластичный, непроницаемый для воды и устойчивый к различным химическим реагентам. Размягчающийся при температуре 260º F, поэтому стерилизуемый кипячением без проблем. Кроме того, в материал хорошо прорастает соединительная ткань.
В 1960-62гг. Ушер сообщил о 541 операции с сеткой Марлекс [66]. Сетку применяли только при больших сложных грыжах, склонных к рецидиву. Рецидив наступил у 10.2% при послеоперационных грыжах и у 5.9% при паховых с числом осложнений 15% и 4.3% соответственно. У 6 из 358 послеоперационных грыж потребовалось удаление сетки из-за инфекции, но этого вообще не потребовалось на 183 паховых грыжи.
Адлер (Adler) в 1962г. опросил общих хирургов США и установил, что 20% используют в сложных случаях сетку [5].
В 1987 Бенхавид (Benhavid) описал протез Марлекс в виде зонтика, помещаемый в преперитонеальное пространство через бедренное отверстие для лечения бедренной грыжи [13]. Этот «зонтик» состоит из диска диаметром 8см и ствола, облегчающего его установку в тканях. После установки и подшивания диска ствол отсекают. На 30 операций при бедренных грыжах не было ни одного рецидива, хотя наблюдали 2 серомы. Позже сообщали о 81 такой операции без рецидива.
Он же описал в 1989 полную реконструкцию пахового дна и паховой связки при помощи полипропиленовой сетки, выкроенной в виде трёх лепестков [14]. Это полное протезирование показано при многократно рецидивирующих грыжах, когда имеет место тотальное разрушение паховой связки и грыжевой дефект простирается до anterior superior iliac spine. Бенхавид сообщил о 26 случаях без инфекции, атрофии яичка, двух серомах. Был 1 рецидив 10 месяцев спустя.
В феврале 1989 главный редактор Американского журнала хирургии Пикок (Peacock) заключил, что следует полностью отказаться от ушивания прямых паховых грыж собственными тканями [56]. «Новая, биологически обоснованная концепция для лечения паховых грыж, приобретенных во взрослой жизни состоит в применении заплат, без натяжения, под местной анестезией, чтобы результат можно было протестировать интраоперационно».
В том же номере журнала Лихтенштейн (Lichtenstein) с коллегами сообщил о 1000 последовательно прооперированных больных с первичной пластикой паховых грыж без натяжения [47]. Сетчатый протез “Марлекс” использовался для прямого закрытия дна пахового канала без сведения тканей дефекта.
Джонс (Jones) и Джакович (Jurkovich) в 1989 получили собственный опыт использования полипропиленовой сетки при инфицированной абдоминальной ране [39]. В их серии они использовали сетку у 5 больных с разлитым перитонитом для закрытия лапаротомной раны. Осложнения развились у 4 пациентов (80%).: тонкокишечный свищ у 4 и расхождение раны – у 1. Во всех случаях сетку пришлось удалить.
Многими хирургами были получены прекрасные результате использования полипропилена. Однако хирурги, не получая полного удовлетворения, совместно с биоэнергетиками продолжают поиск оптимальных биоматериалов для хирургической реконструкции человеческого тела.
Растягивающийся политетрафлюороэтилен
Политетрафлюороэтилен (PTFE) – это фторированный полимер с химической формулой (CF2-CF2). Он был синтезирован в 1938г. его уникальные химические и физические свойства хорошо документированы.
В 1963г. Шинсабуро Ошиге (Shinsaburo Oshige) обнаружил способность PTFE к растягиванию, чему способствовала пористость микроструктуры, которая в совокупности с качеством волокон увеличивала прочность [57]. В 70-е годы его начали применять, как функциональный сосудистый протез, а затем – и в герниологии и других областях хирургии, требующих искусственного замещения утраченной биологической ткани.
Его уникальное качество – пористость микроструктуры, что обеспечивает гибкость, нежность, неразволокняемость, хорошая инфильтрируемость клетками и тканями. Его промышленное название – «Gore-Tex». Он оказался прочнее, чем Марлекс, Пролен, Марсилен как в виде сетки, так и при испытании отдельных швов. С 70-х по 90-е годы материал использовали во многих областях от ортопедической стоматологии до пластической хирургии, реконструкции грудной стенки и, конечно, при паховых и вентральных грыжах.
Ушивание больших первичных или рецидивных вентральных грыж наиболее сложно и ответственно во всей герниологии. Эти операции сопровождаются наибольшим процентом рецидивов, если протезы из биоматериалов не используются. Техника лапароскопического ушивания таких грыж описана и первые результаты обнадёживают, во всяком случае, не наблюдают многие раневые осложнения, типичные для открытого ушивания. Стандартом для использования таких процедур является использование PTFE с его трансабдоминальной фиксацией степлером. Низкий процент рецидивов и осложнений, короткий срок нахождения в стационаре и утраты трудоспособности доказали преимущества лапароскопии.
В последние годы этот протез широко применяют для открытой герниопластики.
Гиллион (Gillion) в 1997 прооперировал 158 больных с вентральными грыжами с использованием PTFE. Развитие инфекции и рецидив были низкими – по 4% на средних сроках 37 мес [33].
В 1999 Гонзалес (Ganzalez) из Испании сообщил о 84 и 98 сложных операциях с PTFE соответственно [35]. Гонзалес на сроках 1-3 года наблюдал развитие инфекции у 1.7% и рецидив – у 2.4%. у 25% его больных сетка установлена по поводу рецидивной грыжи. У Бауэра половина больных были с рецидивами и у 19% наступил повторный рецидив + у 9 потребовалось удаление сетки по поводу нагноения. На сроках 6.2 года рецидив возник у 10 (10.2%) больных без нагноения. Осложнения со стороны кишечника отсутствовали.
Со времени первого применения PTFE в 1983, протез зарекомендовал себя, как эффективный биоматериал, пригодный для решения разнообразных клинических проблем, в том числе – лечения грыж [11].
Рассасывающаяся сетка
Полигликолевая кислота (Дексон) и полиглактин 910 (Викрил-Этикон), сплетённые в сети, представляют собой синтетический рассасывающийся шовный материал. Дексон – мягкий и прочный протез, который рассасывается на протяжении 90 дней. Викрил гибок, но не эластичен, обладает свойствами, сходными с Дексоном. Оба материала рассасывающиеся и не могут быть использованы как протезы в хирургии грыж.
В 1982 Делени (Delany) в эксперименте на собаках показал, что Дексон хорош для окутывания селезенки при её повреждении, а также для тампонады при кровотечении из паренхиматозных органов [25].
В 1983 Ламб (Lamb) ушивал чистую абдоминальную рану с использованием викриловой сетки и установил, что через 3 недели по прочности она не уступала нерассасывающемуся материалу [46]. Однако через 12 недель её прочность была значительно меньше. В результате у 40% крыс развилась грыжа из-за неадекватного прорастания фиброзной ткани в сетку, которая подверглась фибролизу. Он заключил, что Викрил негоден для закрытия ран брюшной стенки.
В 1985 Делени (Delany) на 6 больных впервые сообщил об использовании рассасывающейся сетки при ранении селезенки с хорошим непосредственным результатом и отсутствием осложнений со стороны сетки [26]. Сходные результаты при повреждении сетки и селезёнки представили другие авторы.
В дальнейшем эта сетка успешно использовалась для закрытия тазового дна после обширных онкологических операций, в том числе – с последующим облучением.
Идеальный протез
Зиммерман (Zimmerman) сказал в 1968 “Использование искусственных материалов для пластики грыж вызывает огромный интерес, о чём свидетельствуют и данные литературы. Однако, в этом хаосе предлагаемых материалов и способов операций должен быть наведён определённый порядок и сформулированы основные принципы” [73]. То есть следует обозначить некоторые требования к “идеальному” биоматериалу.
Ещё в 1950 Кумберлад (Cumberland) [22] и Скалес (Scales) [59] сформулировали 8 критериев идеального материала:
1.Не должен физически размягчаться тканевыми соками
2.Должен быть химически инертным
3.Не должен вызывать воспаления или отторжения
4.Не должен обладать канцерогенными свойствами
5.Не должен вызывать аллергию или сенсибилизацию
6.Должен обладать механической прочностью
7.Должен быть пригоден для фабричного изготовления
8.Должен быть пригоден для стерилизации
Ясно, что не существует идеальной операции для лечения грыж и не существует идеального материала для пластики. Три материала на сегодня успешно используют во всём мире для пластики грыж: полиэстеровая сетка, полипропиленовая сетка и растяжимая политетрафторэтиленовая заплата. Они не канцерогенны и не вызывают аллергической реакции. PTFE прочнее двух других, хотя ни разу не было информации о механическом разрушении одного из трёх.
Доказано макроскопически и микроскопически, что все 3 хорошо прорастаются соединительной тканью и коллагеновыми волокнами. PTFE обладает гладкой микропористой поверхностью, в отличие от других.
Когда PTFE имплантируют в брюшную полость, не укрывая брюшиной, на её поверхности быстро образуется тонкий мезетелиально-клеточный слой, который обеспечивает «перитонизацию» висцеральной поверхности протеза. Это уменьшает вероятность образования спаек и возможных осложнений со стороны кишечника, что было доказано ранее экспериментальными и клиническими исследованиями [4].
Рациональный выбор биоматериала должен быть основан на знании достоинств каждого из них.
Будущие биоматериалы должны отвечать трём требованиям идеального протеза:
1.Они должны быть устойчивы к инфекции
2.Они должны предотвращать образование сращений с внутренними органами
3.Они должны вести себя в теле человека, как собственная ткань: хорошо фиксироваться и быть прочными, выдерживать длительное натяжение, без глубокого рубцевания и инкапсулирования, как многие современные протезы.
Перспективны разработки комбинаций различных биоматериалов. Одна из главных задач – предотвращение сращений протеза с кишкой при внутрибрюшном его расположении. Среди апробированных комбинаций только сочетание полипропиленовой сетки с полипропиленовым покрытием в эксперименте на крысах отвечало этим критериям. Однако клинические данные отсутствуют.
В 1996г. Величкав (Velitchkav) описал новый биоматериал, разработанные в Болгарии [69]. Ампоксен, мультифиламентный поликаромид импрегнированный 5-нитро-8-гидроксикуинолином был синтезирован в 1975г. Препарат оказался широко доступен и не дорог, синтезирован в Болгарии. Эта нерассасывающаяся сетка импрегнирован нитроксолином – антисептиком широкого спектра действия. Сетка быстро прорастает фибрином и не приводит к формированию сером. Через 7 дней после имплантации уже трудно отличить Ампоксен от обычных тканей. Автор доложил о 846 паховых грыжесечениях по Лихтенштейну с использованием Ампоксена без рецидивов и низким числом общих осложнений. К сожалению, кроме Болгарии данных об эффективности этого материала нет.
Новый прототип сетки, состоящий из связанных полиэстеровых структур флюорополимера и импрегнированный желатином был описан в 1996 Сорасом (Soares) [61]. Он назван Флюоропассивом. Экспериментальные данные обнадёживают, хотя клиническая информация отсутствует.
Клинч (Klinge) в 1988г. на крысах сконструировал новую сеть, состоящую из комбинации нерассасывающегося полипропилена с рассасывающимся полиглактином 910 [42]. Гистологическое исследование показало низкую тканевую реакцию на имплантат.
Несомненно, что инфекция – главный бич, приводящий к неудаче при герниопластики, независимо от вида биоматериала.
Дент (Dent) в 1992г. проводил эксперимент с использованием Gore-Tex, импрегнированную серебром и хлоргексидином на загрязнённых моделях крыс [27]. Прилипание бактерий к протезу – первый шаг в патогенезе колонизации протеза. Импрегнация протеза антимикробными агентами широкого спектра действия, такими как серебро и хлорэксидин приводит к уменьшению бактериальной колонизации. В этом исследовании 100% контрольной группы были колонизированы, в сравнении с 30% антибактериально импрегнированных. В контрольной группе обсеменённость заплаты составляла более 105 единиц, тогда как опытной группе с серебром – всего 10-200 ед. предварительное исследование показало длительное рассасывание химического агента, пропитывающего сетку – 3 недели. Парентеральное применение антибиотиков для профилактики нагноений, как правило, неэффективно из-за невозможности препарата преодолеть бактериальную биоплёнку, сформированную на поверхности протеза. Это может быть обусловлено бактериальным сцеплением с протезом, приводящим к развитию инфекции и потенциально фатальным септическим осложнениям. Импрегнация сетки серебром или хлоргексидином предотвращает бактериальную колонизацию и последующую инфекцию.
Деборд (DeBord) лабораторно и клинически исследовали данные после имплантации этими антимикробными препаратами у пациентов и не обнаружили каких-либо нежелательных эффектов данного биоматериала [24]. Клинические исследования покажут, доступна ли в коммерческом отношении данная модификация и уменьшает ли данная импрегнация вероятность развития инфекции при грыжесечении.
Таким образом идеальный протез должен быть по одной поверхности импрегнирован антимикробными препаратами и хорошо прорастать соединительной тканью. С другой поверхности он должен обладать противоспаечными свойствами.
- Abrahams Jl, Jonassen OT. The use of polyvinyl sponge in the repair of abdominal wall hernias. Surgery 1957; 42:336.
- Abrahamson J, Eldar S. The nylon darn repair for primary and re current inguinal hernias. Contemp Surg. 1988:32:33.
- Abul-Husn S. The use of polyester mesh in hernia repair. Lebanese Med J l974; 27:437.
- Adler RH. Use of a porous synthetic sponge (Ivalon) in surgery II. Studies of tensile strength. US Armed Forces Med J. 1960; 11:1466.
- Adler RH. An evaluation of surgical mesh in the repair of hernias and tissue defects. Arch Surg. 1962;85:156.
- Adloff M, Arnaud JP. Surgical management of large incisional her nias by an intraperitoneal Mersilenc® mesh and an aponeurotic graft. Surg Gynecol Obstet. 1987:165:204.
- Babcock WW The range of usefulness of commercial stainless steel cloths in general and special forms of surgical practice. Ann West Med Surg. 1952;6:15.
- Ball L. The repair of inguinal hernia and the use of filigrees. BrJ Surg. 1958:45:562
- Bartlett W. An improved filigree for the repair of large defects in the abdominal wall. Ann Surg. l903;38:47.
- Bassini E. Sulla cura radicale dell’ernia inguinale. Arch Soc Ital Chir.
1887;4:380.
- Batter JJ. Harris MT. Kreel I. et al. Twelve-year experience with ex panded polytetrafiuoroethvlene in the repair of abdominal wall defects. Mt Sinai J Med. 1999:66:20.
- Bellis CJ. Immediate unrestricted activity after inguinal herniorrhaphy. International Surg. 1969;52:107.
- Bendavid R. A femoral “umbrella” for femoral hernia repair. Surg Gynecol Obstet. 1987;165:153.
- Bendavid R. New techniques in hernia repair. World J .Surg. 1989; 13:522.
- Blondiau JV, Verheyen V. Coland M. Cure des hernies inguinocru tales par voie médianc prépéritonéale et prothese en Teflon.® Acta Chir Belg. 1979;78:317.
- Callum KG. Doig RI., Kimmonth JB. The results of nylon darn repair for inguinal hernia. Arch Surg. 1974:108:25.
- Cameron AEP, Taylor DEM. Carbon-fibre versus Marlex mesh in the repair of experimental abdominal wall defects in rats. Br J Surg. 1985;72:648.
- Casebolt BT. Use of fabric mesh in abdominal wall defects. J Missouri St Med Assoc. 1975:72:71.
- Cerise EJ. Busuttil RW. Craighead, et al. The use of Mersilene® mesh in repair of abdominal wall hernias: a clinical and experimental study Ann Surg. 1975;181:728.
- Cole PP. The filigree operation for inguinal hernia. Br.J.Surg. 1941; 29:168
- Copello M. Technique and results of Teflon® mesh repair of com plicated re-recurrent groin hernias. Rev Surg. 1968:25:95.
- Cumberland VH. A preliminars report on the use of prefabricated nylon weave in the repair of ventral hernia. Med J Aust. 1952:1:143
- Damnsej PJ. A preperitoneal approach in the prosthetic repair of inguinal hernia. Int .Surg. 1985;70:223.
- De Bord JR, Bauer JJ, Short-term study on the safety of antimicrobial-agent-impregnated ePTFE patches for hernia repair. Hernia 2000. In press.
- Delani UM, Porreca F, Iitsudo S. et al. Splenic capping: an experimental study of a new technique for splenorrhaphy using woven polyglvcolic acid mesh. Ann Surg. 1982:96:187.
- Delany HM. Rudavsky A. Lan S. Preliminary clinical experience with the use of absorbable mesh spknorrhaphy. J Trauma. 1985:25:909.
- Dent L. Modak S. Sampath I. et al. Evaluation of an infection- resistant silver-chlorhexidine-impregnated FIFE soft tissue patch. Surg Forum. 1992;XLIII:70.
- Doran FSA. Gibbins RE, Whitehead R. A report on 313 inguinal herniae repaired with nylon nets. Br J Surg. 1961:48:430.
- Druart ML. Lixnbosch JM. Traitement des eventrations par implan tation intrapéritonéale de voile en Teflon. Ann Chir 1988;42:39.
- Durdeti JG, Pemberton LB. Dacron® mesh in ventral and inguinal hernias. Am Surgeon. 1974;40:662.
- Flynn WJ. Brant AE, Nelson GG. A four and one-half sear analysis of tantalum gauze used in the repair of ventral hernia. Ann Surg 1951:134:1027.
- Gibson I.D. Stafford CE. Synthetic mesh repair of abdominal wall defects. Am .Surg. 1964;30:48l.
- Gillion JF, Begin. Expanded politetrafluoroethylene patches used in the intraperitoneal or extrapentoneal position for repair of incisional hernias of the anterolateral abdominal wall. Am J Surg. 1997:174:16.
- Goepеl R. Ueber die Verschliessung von Bnichpfortcn durch Eiii heilung geflochtener fertiger Silberdrahtnetze (Silberdrahtpelotten). Verh Disc Ges Chir 1900:19:174.
- Gonzalez AU. de la Portlier Dejuan F, Albarrán GC. Large incisional hernia repair using intraperitoncal placement of expanded polytetrafluoroethylene. Am J Surg. 1999:177:291.
- Grindlay JH, Clogett ОT. Plastic sponge prosthesis for use after pneumonectotnv. Proc Staff Meet Mayo Clinic. 1949:24:538.
- Greenstein SM. Murphy IT, Rush BF. et al. The experimental evaluation of a carbon-polylactic acid mesh for a ventral herniorrhaplsv. Curr Surg. 1984:41:358.
- <
endoscan.ru
| Космопор е 15*8 см 1 повязка стерильная ООО Еврофарм |
| Космопор е 20*8 см 1 повязка стерильная ООО Еврофарм |
| Космопор е 20*10 см 1 повязка стерильная ООО Еврофарм |
| Повязка Космопор Е 20x10см 1 шт. РУФАРМА, ООО |
| Повязка Космопор е 1 шт РУФАРМА, ООО |
| Космопор е 35*10 см 1 повязка стерильная ООО Еврофарм |
| Повязка космопор е 7,2x5см n5 7,2х5см 5 шт. РУФАРМА, ООО |
| Повязка космопор е 7,2x5см n10 7,2x5см n10 РУФАРМА, ООО |
| Космопор антибактериал 7,2*5 см 5 повязок с серебром ООО Еврофарм |
| Космопор е 10*8 см 10 повязок стерильных ООО Еврофарм |
| Повязка космопор е 15x9см n10 15x9см n10 РУФАРМА, ООО |
| Повязка Космопор Е 10x6см n25 РУФАРМА, ООО |
| Повязка Космопор Е 7,2х5см 50 шт. РУФАРМА, ООО |
| Космопор повязка самокл 10 * 6 N25 ООО Еврофарм |
| Космопор Е Повязка 15 x 6 см. 25 шт. РУФАРМА, ООО |
| Космопор E повязка 10 x 8 см. 25 шт. РУФАРМА, ООО |
| Повязка Космопор Е 20x10см 10 шт. РУФАРМА, ООО |
| Повязка Космопор Е 15х8см 25 шт. РУФАРМА, ООО |
| Космопор е 15*8 см 25 повязок стерильных ООО Еврофарм |
| Космопор повязка самокл 25 * 10 N25 ООО Еврофарм |
| Повязка Космопор Е 35x10см 25 шт. РУФАРМА, ООО |
www.neboleem.net


 Еще в недавнем обозримом прошлом лечение различных нарушений кожных покровов сопровождалось использованием весомого количества перевязочного материала – ваты, марли, бинтов. Медицина 21-го века применяет более технологичные современные продукты, один из которых – Космопор.
Еще в недавнем обозримом прошлом лечение различных нарушений кожных покровов сопровождалось использованием весомого количества перевязочного материала – ваты, марли, бинтов. Медицина 21-го века применяет более технологичные современные продукты, один из которых – Космопор.